
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=5I-+IO3-+3H2O
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是 (用化学式表示);CCl4中显紫红色的物质是 (用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
A.Na2S2O3 B.AlCl3
C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:
(1)①Fe(SCN)3 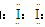
②IO3-+5I-+6H+=3I2+3H2O 2Fe3++2I-=2Fe2++I2
(2)O2+4KI+2H2O=2I2+4KOH 否
KI3在受热(或潮湿)条件下产生I2和KI,KI易被氧气氧化,I2易升华
(3)AC
(4)取足量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如:氯水、过氧化氢等),再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+
【解析】(1)①加KSCN溶液后显红色,发生的反应为:Fe3++3SCN-=Fe(SCN)3,红色物质是Fe(SCN)3;CCl4中显紫红色的物质是I2,其电子式为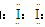 。
。
②由(1)中信息可知,加碘盐中含有Fe3+和IO3-,试液中加入足量KI固体后,发生的离子反应为:IO3-+5I-+6H+=3I2+3H2O,2Fe3++2I-=2Fe2++I2。
(2)KI具有还原性,在潮湿的环境中与O2发生氧化还原反应:O2+4KI+2H2O=2I2+4KOH。由题中信息可知,KI3·H2O在受热(或潮湿)的条件下发生反应KI3??KI+I2,而KI易被氧气氧化为I2,而I2受热易升华,从而引起碘的损失,故KI3·H2O不适合做食盐加碘剂。
(3)由于还原性:S2O32->I-,故加Na2S2O3可减少KI被氧化;由3I2+6OH-=5I-+IO3-+3H2O可知,I-在碱性条件下不易被氧化为I2,故加入Na2CO3也可减少KI被氧化,故Na2S2O3、Na2CO3均可作稳定剂。
(4)取足量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氯水或过氧化氢等氧化剂,再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+,涉及的反应有:2Fe2++Cl2=2Fe3++2Cl-或2Fe2++H2O2+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 10-3 常见气体的制备练习卷(解析版) 题型:填空题
某学生用实验室常见的酸、碱、盐和金属单质为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的装置。试回答:
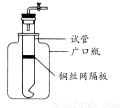
(1)若试管中装有铜丝网隔板,利用该装置可制取哪些气体?
(写出两种)。
(2)若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体? 。该反应的离子方程式是: 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 10-2 物质的检验、分离和提纯练习卷(解析版) 题型:选择题
某同学为检验溶液中是否含有常见的几种无机离子,进行了如下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
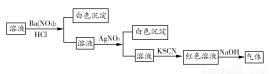
A.原溶液中一定含有SO42-
B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl-
D.原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 10-2 物质的检验、分离和提纯练习卷(解析版) 题型:选择题
用下列实验装置进行相应实验,能达到实验目的的是( )
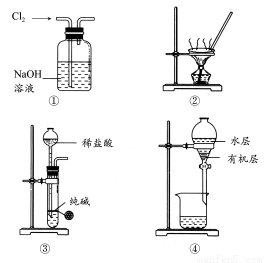
A.用图①所示装置除去Cl2中含有的少量HCl
B.用图②所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图③所示装置制取少量纯净的CO2气体
D.用图④所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-4 氧化还原反应练习卷(解析版) 题型:选择题
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1:4 B.1:2 C.2:1 D.4:1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-4 氧化还原反应练习卷(解析版) 题型:选择题
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为:
aTiO2+bCl2+cC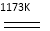 aTiCl4+cCO……反应①
aTiCl4+cCO……反应①
TiCl4+2Mg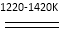 Ti+2MgCl2……反应②
Ti+2MgCl2……反应②
关于反应①②的分析不正确的是( )
A.TiCl4在反应①中是还原产物,在反应②中是氧化剂
B.C、Mg在反应中均为还原剂,被氧化
C.每生成0.4 mol Ti,反应①②中共转移3.2 mol e-
D.反应①②都是置换反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-3 溶液的配制及分析练习卷(解析版) 题型:选择题
某500 mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后溶液体积不变)( )
A.0.4 mol·L-1 B.0.6 mol·L-1
C.0.8 mol·L-1 D.1.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-3铁、铜的获取及应用练习卷(解析版) 题型:选择题
下列各图示中能较长时间看到Fe(OH)2白色沉淀的是 ( )。
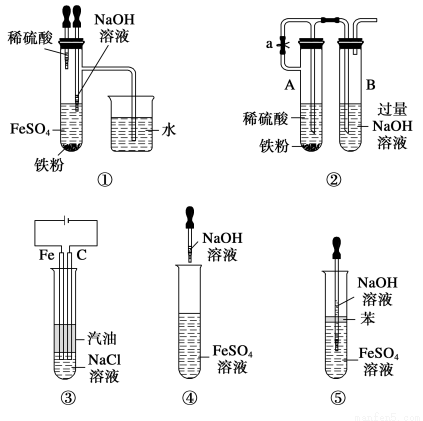
A.①②③④⑤ B.①②③⑤
C.①②③④ D.②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com