
分析 (1)二氧化硫与水反应生成亚硫酸,亚硫酸具有还原性被空气中的氧气氧化生成硫酸;
(2)二氧化硫与过量的氢氧化钠反应生成亚硫酸钠和水;
(3)碳酸钙和氧气和二氧化硫反应生成硫酸钙和水,根据反应物与生成物来书写化学反应方程式.
解答 解:(1)SO2、O2形成硫酸型酸雨的反应:SO2+H2O=H2SO3; 2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4;
故答案为:SO2+H2O=H2SO3; 2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4;
(2)二氧化硫与氢氧化钠反应的离子方程式:2OH-+SO2═SO32-+H2O,故答案为:2OH-+SO2═SO32-+H2O;
(3)向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4,发生的化学反应为2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2,
故答案为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2.
点评 本题考查了二氧化硫的性质,明确二氧化硫为酸性氧化物,具有还原性是解题关键,题目较简单.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
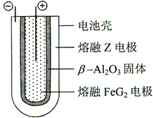 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子. ;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 灼烧硝酸铷时,火焰有特殊颜色 | |
| B. | 氯化铷是离子化合物 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 聚氯乙烯塑料强度大,抗腐蚀性强,可以用来包装需长时间保存的食品 | |
| C. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| D. | 用于食品包装的塑料制品,属于热塑性塑料,可回收再利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
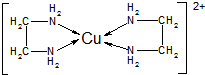
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在能使石蕊试纸变蓝色的溶液中:Na+、SO32ˉ、S2ˉ、SO42ˉ | |
| B. | 由水电离的H+浓度c(H+)=10-12mol•L-1的溶液中:Clˉ、CO32ˉ、NH4+、NO3ˉ | |
| C. | 在加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3ˉ | |
| D. | pH=2的溶液中:Na+、SO42ˉ、NO3ˉ、AlO2ˉ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com