
| A. | ②中水的电离程度的是①的8倍 | |
| B. | ①和③中水的电离程度相等 | |
| C. | 等体积的①和④混合后所得溶液中:c(NH3•H2O)<c(NH4+) | |
| D. | ②中水的电离程度等于④ |
分析 A、酸碱抑制水的电离,能水解的盐对水的电离起到促进作用;
B、根据水电离出的氢离子以及氢氧根离子浓度计算水电离程度;
C、等体积的①和④混合后所得溶液是硝酸钠和一水合氨的混合物,显示碱性,据此回答;
D、根据两个溶液中弱离子水解程度来判断对水电离程度的影响.
解答 解:A、②pH=11的NaCN溶液中水电离出的氢离子浓度是0.001mol/L,①pH=11的NaOH溶液中水电离出的氢离子浓度是10-11mol/L,②中水的电离程度的是①的108倍,故A错误;
B、①pH=11的NaOH溶液中水电离出的氢离子浓度是10-11mol/L,pH=3的盐酸中水电离出的氢离子浓度是10-11mol/L,和③中水的电离程度相等,故B正确;
C、等体积的①和④混合后所得溶液是硝酸钠和一水合氨的混合物,显示碱性,c(NH3•H2O)>c(NH4+),故C错误;
D、②pH=11的NaCN溶液中水电离出的氢离子浓度是0.001mol/L,0.001mol•L-1的NH4NO3溶液中水电离出的氢离子浓度小于0.001mol/L,故D错误.
故选B.
点评 本题是一道关于水的电离平衡的盐的水解平衡原理的综合应用知识,注意知识的迁移应用是关键,难度中等.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:实验题
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯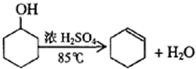
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
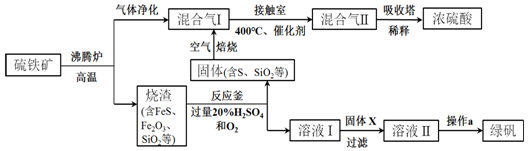
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9m~10-7m之间 | |
| B. | 用平行光照射NaCl溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液与NaOH溶液混合,以制取Fe(OH)3胶体 | |
| D. | 除去Fe(OH)3胶体中的H+、Cl-,可用渗析的实验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2p1>p2 | B. | PCl5的分解率增大 | ||
| C. | p1>p2 | D. | Cl2的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  =KCl+3Cl2↑+3H2O =KCl+3Cl2↑+3H2O | |
| B. | H2S+H2SO4(浓)═S↓+SO2↑+2H2O | |
| C. | 2H2S+SO2═3S↓+2H2O中氧化剂与还原剂的物质的量之比是1:2 | |
| D. | 3NO2+H2O═2HNO3+NO中氧化剂与还原剂的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
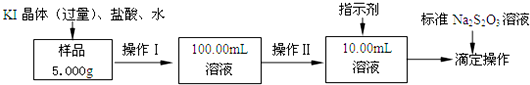
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
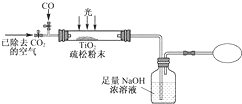
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com