

分析 (1)I.H为+1价,Cl为-1价,化合物中正负化合价的倒数和为0;
II.a-b点间,溶液中氨氮去除率迅速提高,与c(NaClO)增大生成HClO有关;
(2)I.水解生成HClO;
II.pH较高时,氨氮去除率下降,与OH-抑制NaClO水解有关;pH较低时,氨氮去除率也下降与c(HClO)太高致HClO易分解有关;
(3)由图可知,电解时Cl-失去电子转化为HClO,HClO可氧化氨气生成氮气,则d连接电源正极为阳极.
解答 解:(1)Ⅰ.H为+1价,Cl为-1价,化合物中正负化合价的倒数和为0,则N元素的化合价为0-(+1)×2-(-1)=-1,
故答案为:-1;
Ⅱ.a-b点间,溶液中氨氮去除率迅速提高的原因是c(NaClO)增大,水解平衡正向移动,使c(HClO)增大,NH3被氧化为N2速度加快,
故答案为:c(NaClO)增大,水解平衡正向移动,使c(HClO)增大,NH3被氧化为N2速度加快;
(2)Ⅰ.反应①②中HClO 的来源用化学用语解释是ClO-+H2O?HClO+OH-,
故答案为:ClO-+H2O?HClO+OH-;
Ⅱ.pH较大时,c(OH-)较大,抑制NaClO水解,c(HClO)较小致氧化能力弱,去除率降低;pH较小时,c(H+)较大,促进NaClO水解,c(HClO)太高致HClO易分解,去除率降低,
故答案为:c(OH-)较大,抑制NaClO水解,c(HClO)较小致氧化能力弱;c(H+)较大,促进NaClO水解,c(HClO)太高致HClO易分解;
(3)由图可知,电解时Cl-失去电子转化为HClO,HClO可氧化氨气生成氮气,则d连接电源正极为阳极,可知a为负极,d为阳极,阳极反应为Cl--2e-+H2O=H++HClO,
故答案为:负极;Cl--2e-+H2O=H++HClO.
点评 本题考查化学平衡及电解原理,为高频考点,把握图象分析、平衡移动原理及电极反应为解答的关键,侧重分析与应用能力的考查,注意信息的应用,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10%的葡萄糖溶液加入新制氢氧化铜悬浊液中,加热可得到砖红色沉淀 | |
| B. | 苯加入到溴水中,苯和溴发生取代反应而使溴水褪色 | |
| C. | 在洁净的试管中加入1~2 mL AgNO3溶液,再滴加稀氨水,直到AgOH完全沉淀,即制得银氨溶液 | |
| D. | 在空气中灼烧铜丝,待铜丝冷却后伸入乙醇中,反复多次,可以制得乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
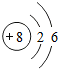 ,b的最简单氢化物的电子式为
,b的最简单氢化物的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 290 | 39 | 11.7 |
| 实验Ⅰ | 实验Ⅱ | |
| 通入气体 | CO、H2 | CO、H2、H2O(g) |
| 固体产物 | Fe3O4、Fe | Fe3O4 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C、D三种元素形成的化合物一定是共价化合物 | |
| B. | 工业上常用电解E与F形成的化合物的方法制取单质E | |
| C. | 原子半径由大到小的顺序:D>C>B>A | |
| D. | B、C、F元素最高价氧化物水化物酸性最强的是F |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Rb与冷水反应比K更剧烈 | B. | Rb投入CuSO4溶液中可置换出Cu | ||
| C. | Rb与O2反应只有Rb2O产生 | D. | Rb2CO3难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
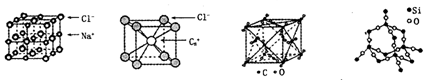
| A. | 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同 的晶体结构 | |
| B. | 氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似物理 性质 | |
| C. | 二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 | |
| D. | 二氧化硅晶体不是密堆积结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com