
| A. | 浓度为0.1 mol/L CH3COOH与0.1 mol/L CH3COONa混合后溶液呈弱酸性,则c(CH3COOH>c(Na+)>c(CH3COO-) | |
| B. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ | |
| C. | NaHCO3溶液:c(OH-)-c(H+)=c((HCO3-)+2c(H2CO3) | |
| D. | 等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
分析 A.物质的量浓度各为0.1mol•L-1CH3COOH 和CH3COONa溶液等体积混合后,溶液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度;
B.酸或碱抑制水电离,含有弱根离子的盐促进水电离,酸的酸性越强,其抑制水电离程度越大,据此分析解答;
C.碳酸氢钠溶液中存在物料守恒和电荷守恒,计算分析判断;
D.溶液中存在的物料守恒分析,等物质的量浓度的NaClO、NaHCO3混合溶液中,钠离子浓度相同;
解答 解:A.溶液呈酸性,说明醋酸的电离程度大于醋酸根离子水解程度,所以c(CH3COO-)>c(Na+)>c(CH3COOH),故A错误;
B.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中,醋酸和盐酸溶液中氢离子浓度相同,所以抑制程度相同,氯化铵是强酸弱碱盐,促进水电离,所以由水电离出的C(H+)大小关系正确的是①>②=③,故B错误;
C.根据电荷守恒得C(H+)+C(Na+)=c(OH-)+C(HCO3-)+2C(CO32-),根据物料守恒得C(HCO3-)+C(CO32-)+C(H2CO3)=C(Na+),计算得到,c(OH-)-c(H+)=c(H2CO3)-C(CO32-),故C错误;
D.等物质的量浓度的NaClO、NaHCO3混合溶液中物料守恒,C(Na+)=c(HClO)+c(ClO-),C(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),得到c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故D正确;
故选D.
点评 本题以盐类水解为载体考查离子浓度大小比较,水的电离影响因素,任何电解质溶液中都存在电荷守恒和物料守恒,与电解质溶液浓度大小无关,与溶液中电解质种类多少无关,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用焰色反应可以检验某些金属元素 | |
| B. | C元素和S元素在自然界中既有游离态,又有化合态 | |
| C. | SO2和Na2O2都能使紫色石蕊试液褪色,但漂白原理不同 | |
| D. | 新型陶瓷,玻璃,水泥不都是硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①⑤ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为8NA | |
| C. | 0.5 摩1,3-丁二烯分子中含有C=C双键数为 NA | |
| D. | 1 mol碳正离子(CH3+)所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ||||||
| 4 | ⑧ | ⑨ | ||||||
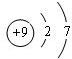 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 家里用的金龙鱼油和猪油都是可皂化的饱和酯类 | |
| B. | 亲购买保温杯时可选购304不锈钢材质的,这种材料耐高温,韧性好,这是一种合金 | |
| C. | 做衣服用的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=3.0×10-8 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做过KMn04分解反应实验的试管(浓盐酸) | |
| B. | 做过木炭还原氧化铜实验的试管(硝酸) | |
| C. | 做过银镜反应实验的试管(氨水) | |
| D. | 做过Na2S2O3与稀硫酸反应的试管(二硫化碳) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=11 | B. | pH=10.3 | ||
| C. | c(H+)=2×10-12 mol•L-1 | D. | c(H+)=(10-12+10-10)/2 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com