
 ,故答案为:
,故答案为: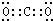 ;
;

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| A、H2O |
| B、NaHCO3 |
| C、Na2CO3 |
| D、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100 mL 2 mol/L的盐酸与锌反应时,加入3mol/L的稀硝酸溶液,生成氢气的速率加快 |
| B、用锌片和稀硫酸反应制取氢气,加入足量的硫酸铜溶液一定可以加快产生氢气的速率 |
| C、在做草酸与高锰酸钾的反应时,加入少量硫酸锰作催化剂可加快溶液褪色速率 |
| D、汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,若升高温度,则吸热反应速率增大,放热反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁表面发生吸氧腐蚀时,钢铁表面水膜的pH增大 |
| B、在镀件上电镀锌,可以用锌作阳极,也可以用惰性电极材料作阳极 |
| C、电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量少 |
| D、工作时在原电池的负极和电解池的阳极上都是发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②③ | C、②⑤ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、两个反应都是置换反应 |
| B、两个反应中的H2均为还原剂 |
| C、两个反应的条件不同 |
| D、两个反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)将反应2H2(g)+O2(g)=2H2O(1)△H<0,以KOH溶液为电解质溶液,设计一个原电池,其负极反应为:
(1)将反应2H2(g)+O2(g)=2H2O(1)△H<0,以KOH溶液为电解质溶液,设计一个原电池,其负极反应为:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同体积和物质的量浓度的不同溶液里所含溶质的物质的量相同 | ||
| B、10mol/L的浓盐酸与H2O等质量混合所得混合液的浓度为5mol/L | ||
C、溶液中溶质质量分数为w,密度为ρg?cm-3,溶质摩尔质量为Mg?mol-1的溶液的物质的量浓度为
| ||
| D、一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com