
在一定容积的密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)2C(g) ΔH<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合右图中曲线的是 ( )。
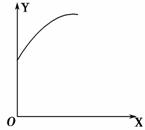
| X | Y | |
| A | 再加入A | B的转化率 |
| B | 加入催化剂 | A的体积分数 |
| C | 充入氦气 | A的转化率 |
| D | 升高温度 | C的体积分数 |
科目:高中化学 来源: 题型:
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
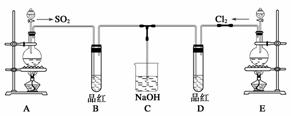
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是________________________________________________
(2)实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子总数为_______________________;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:____________________________________,D:______________________________。
②停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:____________________________________,D:________________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_______________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列装置图回答问题(装置图用符号表示):
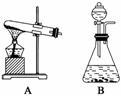
(1)双氧水(H2O2)是无色液体,可发生如下化学反应:2H2O2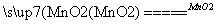 2H2O+O2↑。
2H2O+O2↑。
反应中MnO2的作用是________。在实验室利用此反应制取氧气时,应选用的气体发生装置是________,简述检查本装置气密性的方法: _______________________________
________________________________________________________________________。
(2)KClO3在MnO2作催化剂时,加热也可以制得氧气。应选用的气体发生装置是
________。
(3)为了验证MnO2在KClO3分解过程中起到了催化剂作用,我们要把反应后的产物分离,提取出MnO2并验证其的确是催化剂。分离出MnO2的操作有________、________、洗涤、烘干、称量。为证明MnO2是催化剂,还需要知道的一个数据是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项与化学平衡移动原理无关的是 ( )。
A.收集氯气用排饱和食盐水的方法
B.加催化剂,使N2和H2在一定的条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.加压条件下有利于SO2和O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
xA(g)+2B(s)yC(g) ΔH<0
在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
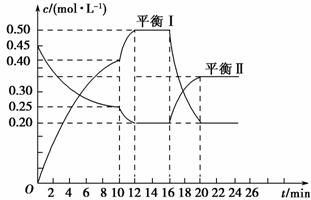
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O
对实验现象的“解释或结论”正确的是( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |

查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA
B.标准状况下,22.4 L NH3中含有共价键的数目为NA
C.1 molCl2与足量Fe反应转移电子数一定为3NA
D.标准状况下,11.2 L SO3所含的分子数目为0.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com