
| A. | 蛋白质、淀粉和油脂都属于高分子化合物 | |
| B. | 人造纤维.合成纤维.碳纤维.光导纤维主要成分都是纤维素 | |
| C. | 误食重金属盐类时,可以喝大量牛奶、蛋清或豆浆解毒 | |
| D. | 福尔马林主要成分是甲酸,由于可使蛋白质变性,可用于保存动物标本 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
| 40 | 40.1 | 36.4 | 26.3 | 215 | |
| 80 | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO32-和Br-浓度都会减小 | B. | 溶液颜色会发生变化 | ||
| C. | 该过程中不会有沉淀生成 | D. | 离子浓度基本保持不变的只有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100kg | B. | 160kg | C. | 240kg | D. | 300kg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
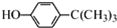 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: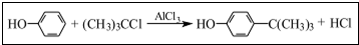 .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.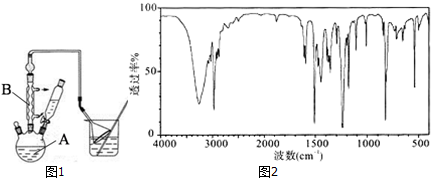
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
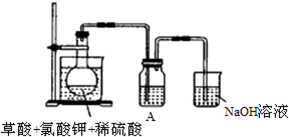
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
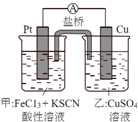
| A. | 该原电池的正极反应是Cu2++2e-=Cu | |
| B. | 甲烧杯中溶液的血红色逐渐变浅 | |
| C. | 盐桥中的SO42-流向甲烧杯 | |
| D. | 若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com