
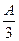 g,则溶液中的阳离子一定有 、可能有 、一定没有 。
g,则溶液中的阳离子一定有 、可能有 、一定没有 。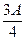 g,则溶液中的阳离子一定有 、一定没有 。
g,则溶液中的阳离子一定有 、一定没有 。 科目:高中化学 来源:不详 题型:填空题
 +、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐
+、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐 酸中,所得溶
酸中,所得溶 液与原溶液相比,溶液中大量减少的阳离子是 ;
液与原溶液相比,溶液中大量减少的阳离子是 ;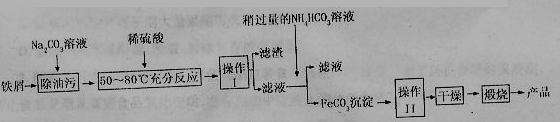
 。
。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
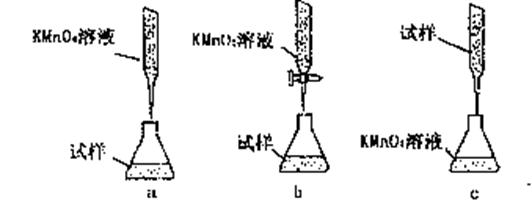
 过程中,设计了如下实验方案:
过程中,设计了如下实验方案: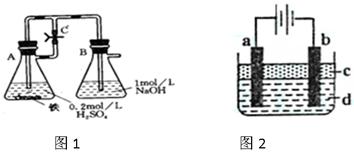
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3O4 | B.Fe4O5 | C.Fe5O6 | D.Fe5O7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.00 mol·L-1 | B.2.80 mol·L-1 |
| C.3.30 mol·L-1 | D.3.50 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
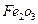 、4mol
、4mol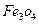 和3mol Fe0组成的混合物,加入纯铁1mol并在高温下和
和3mol Fe0组成的混合物,加入纯铁1mol并在高温下和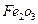 反应。若纯铁完全反应,则反应后混合物中Fe0与
反应。若纯铁完全反应,则反应后混合物中Fe0与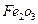 的物质的量之比可能是
的物质的量之比可能是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com