
| A. | 2克氢气 | B. | 20克的二氧化硫 | C. | 46克的金属钠 | D. | 3摩尔的水 |
分析 相同条件下气体摩尔体积相等,根据V=nVm可知,气体的物质的量越大,气体体积越大;一般固体、液态体积小于气体,据此进行解答.
解答 解:A.2g氢气的物质的量为:$\frac{2g}{2g/mol}$=1mol;
B.20g二氧化硫的物质的量为:$\frac{20g}{64g/mol}$=$\frac{5}{16}$mol;
C.46gNa的物质的量为:$\frac{46g}{46g/mol}$=1mol;
D.3mol水;
相同条件下,物质的量相等时,固体、液态的体积小于气体,根据V=nVm可知,气体的物质的量越大,气体体积越大,所以体积最大的为A,
故选A.
点评 本题考查了物质的量计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积的关系为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:实验题
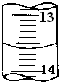 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
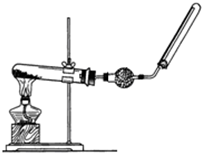 实验室中若用如图所示的装置制取并收集干燥的氨气.
实验室中若用如图所示的装置制取并收集干燥的氨气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
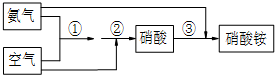
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
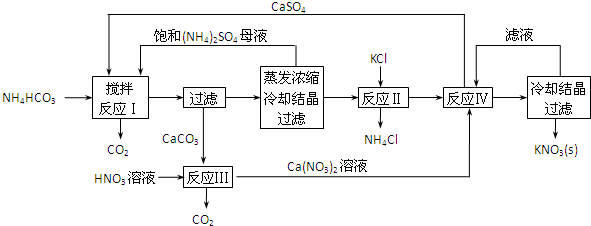
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
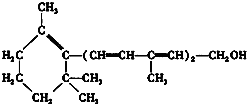
| A. | 维生素A是一种酚 | |
| B. | 维生素A的一个分子中有三个双键 | |
| C. | 维生素A可以使酸性高锰酸钾溶液褪色 | |
| D. | 维生素A具有环己烷的结构单元 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
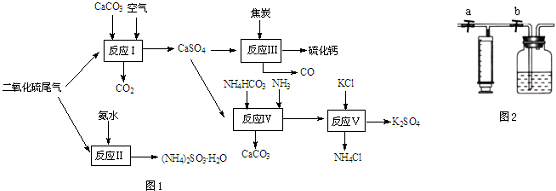
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 第三周期元素的离子半径从左到右逐渐减小 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | ⅣA族元素的氢化物中,稳定性最好的是CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
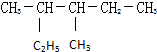 的系统命名:3,4-二甲基己烷
的系统命名:3,4-二甲基己烷 的键线式:
的键线式:
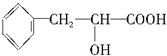
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com