
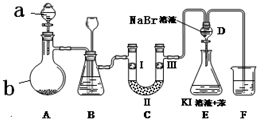
 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
分析 (1)熟悉仪器的构造和形状说出其名称;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,依据氯化氢和氯气在水中溶解度选择合适的试剂除杂;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大;
(3)次氯酸钙与浓盐酸反应生成氯化钙、氯气与水;
(4)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(5)依据氧化还原反应规律,氧化性强的物质能够制备氧化性弱的物质;
(6)打开活塞,将装置D中少量溶液加入装置E中,生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于苯中,振荡分层,苯层在上层;
(7)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:(1)装置A中仪器a名称为分液漏斗,b为圆底烧瓶;
故答案为:分液漏斗;圆底烧瓶;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,所以B中饱和食盐水可以除去Cl2中的HCl;
故答案为:饱和食盐水;
(3)次氯酸钙与浓盐酸反应生成氯化钙、氯气与水,反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,
故答案为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
(4)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选c,
故答案为:c;
(5)当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明氯气能够与溴离子反应生成单质溴,氯气的氧化性强于溴,所以非金属性氯大于溴;
故答案为:大于;
(6)打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡.观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色,
故答案为:E中溶液分为两层,上层(苯层)为紫红色;
(7)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氯气实验室制取、氯气化学性质、实验设计、实验装置的理解评价、化学方程式的书写等,题目综合性强,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢铝化合物与水反应生成氢氧化铝和氢气 | |
| B. | 氢铝化合物中铝显+3价,氢显-1价 | |
| C. | 铝与水蒸气高温下反应生成氢铝化合物 | |
| D. | 氢铝化合物具有强还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水的体积为vL | |
| B. | 加水的质量为mg | |
| C. | 0.5amol/L的氨水质量分数等于0.5b% | |
| D. | 0.5amol/L的氨水质量分数小于0.5b% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 试剂 | 分离方法 | |
| A | 硝酸钾(氯化钠 ) | 蒸馏水 | 降温结晶 |
| B | 氢氧化铁胶体(Fe3+) | 蒸馏水 | 渗析 |
| C | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| D | 乙醇(水) | 生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LO2所含的分子数目为NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 7.8gmolNa2O2与H2O反应转移电子数目为0.1NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com