
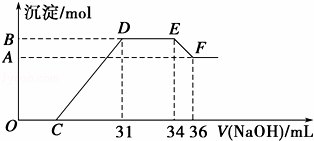
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,最低可以还原到﹣3价.某同学取一定量的铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)请写出该合金中铁与硝酸反应的离子方程式 .
(2)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 .
(3)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 .
(4)B与A的差值为 mol.
(5)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL.
考点: 离子方程式的有关计算.
分析: 铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了﹣3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H++OH﹣=H2O,
②Fe3++3OH﹣=Fe(OH)3↓,Al3++3OH﹣=Al(OH)3↓,
③NH4++OH﹣═NH3•H2O,
④Al(OH)3 +OH﹣=AlO2﹣+2H2O.
(1)金属铁和稀硝酸反应生成硝酸铁、一氧化氮和水,据此回答;
(2)O→C 之间没有沉淀生成,说明硝酸过量,O→C之间发生的反应酸碱中和反应;
(3)D与E一段沉淀的量没有发生变化,为NH4NO3和NaOH反应;
(4)E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,利用发生的化学反应来计算;
(5)沉淀的总量可根据NH4+的量,根据NH4++OH﹣═NH3•H2O 得出n(NH4+),根据氧化还原反应,N元素由+5价变为﹣3价,而金属都由0价变为+3价,可以运用电子守恒得出金属的物质的量.
解答: 解:铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了﹣3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H++OH﹣=H2O,
②Fe3++3OH﹣=Fe(OH)3↓,Al3++3OH﹣=Al(OH)3↓,
③NH4++OH﹣═NH3•H2O,
④Al(OH)3 +OH﹣=AlO2﹣+2H2O
(1)根据图示得到的溶液和氢氧化钠反应产生沉淀的情况可以知道,金属铁和稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式为:8Fe+30H++3NO3﹣=8Fe3++3NH4++9H2O,故答案为:8Fe+30H++3NO3﹣=8Fe3++3NH4++9H2O;
(2)OC之间没有沉淀生成,说明硝酸过量,OC之间发生的反应酸碱中和反应,离子方程式为H++OH﹣═H2O,故答案为:H++OH﹣═H2O;
(3)DE一段沉淀的量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为NH4++OH﹣═NH3•H2O,故答案为:NH4++OH﹣═NH3•H2O;
(4)由图可知,EF段消耗的氢氧化钠溶液为36mL﹣34m=2mL,故该计算参加反应的氢氧化钠为0.002L×4mol/L=0.008mol,根据Al(OH)3 +OH﹣=AlO2﹣+2H2O可知,Al(OH)3的物质的量为0.008mol,即为B、A的差值,故答案为:0.008;
(5)图中OC段没有沉淀生成,此阶段发生的离子方程式为H++OH﹣=H2O;在DE段沉淀的物质的量没有变化,应为NH4+和OH﹣的反应,此阶段发生反应的离子方程式为NH4++OH﹣═NH3•H2O;根据NH4++OH﹣═NH3•H2O 得:n(NH4+)=(34﹣31)×10﹣3L×4mol/L=0.012 mol,根据氧化还原反应,N元素由+5价变为﹣3价,而金属都由0价变为+3价,可以运用电子守恒得出金属的物质的量为: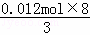 =0.032mol,所以生成沉淀的物质的量为0.032mol,
=0.032mol,所以生成沉淀的物质的量为0.032mol,
设Mg为xmol,Al为0.008mol,生成硝酸铵为(34﹣31)×0.001L×4mol/L=0.012mol,
由电子守恒可知,2x+0.008×3=0.012×8,
解得x=0.036mol,
滴加NaOH体积为31ml时,
发生反应为①H++OH﹣=H2O,②Mg2++2OH﹣=Mg(OH)2↓,Al3++3OH﹣=Al(OH)3↓,
则C点氢氧化钠溶液的体积为31mL﹣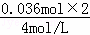 ×1000mL﹣
×1000mL﹣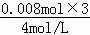 ×1000L=7mL,
×1000L=7mL,
故答案为:0.032;7.
点评: 本题考查金属与硝酸的反应、氧化还原反应、化学计算等知识点,属于中等难度试题,解答此题关键是判断出硝酸的还原产物以及电子转移守恒的运用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列反应既属于非氧化还原反应,又是吸热反应的是( )
A.铝片和稀硫酸反应 B.Ba(OH)2•8H2O与NH4Cl反应
C.灼热的碳与二氧化碳反应 D.甲烷在氧气中燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.标准状况下,22.4L己烷中含己烷分子数目为NA
B.28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA
C.71gNa2SO4固体中含钠离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组通过实验探究Cu及其化合物的性质,操作正确且能达到目的是( )
A. 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色
B. 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成
C. 金属钠放入硫酸铜溶液中可以置换出金属铜
D. 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
A. n(Cl2):n(Fe)=5:4 5Cl2+4Fe  2FeCl2+2FeCl3
2FeCl2+2FeCl3
B. n(Cl2):n(FeBr2)=1:1 Fe2++2Br﹣+Cl2═Fe3++Br2+2Cl﹣
C. n(MnO4﹣):n(H2O2)=2:3 2MnO4﹣+3H2O2+6H+═2Mn2++4O2↑+6H2O
D. n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3﹣═3Fe2++Fe3++3NO↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象预测正确的是( )
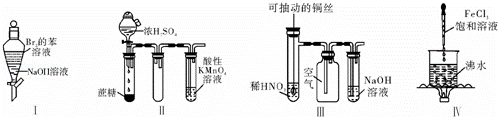
|
| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 |
|
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,但颜色不变 |
|
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
|
| D. | 实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
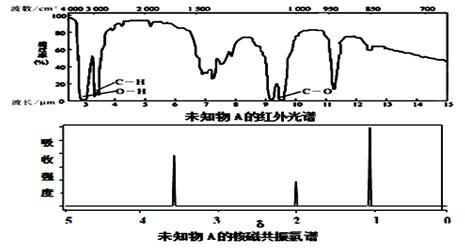
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.若A的化学式为C2H6O,则其结构简式为CH3-O-CH3
D.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.医用酒精的浓度通常为95%
B.单质硅是将太阳能转变为电能的常用材料
C.淀粉、纤维素和油脂都属于天然高分子化合物
D.合成纤维和光导纤维都是新型无机非金属材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com