
| A. | 元素的单质一定由氧化或还原该元素的化合物制得 | |
| B. | 一个氧化还原反应中,氧化剂和还原剂一定是两种不同的物质 | |
| C. | 阳离子只能得到电子被还原,阴离子只能失去电子被氧化 | |
| D. | 含有最高价元素的化合物不一定具有很强的氧化性 |
分析 A.不活泼金属元素的单质可由自然界直接得到;
B.对于发生歧化反应的物质,氧化剂、还原剂为同一种物质;
C.阳离子如处于中间价态,可被氧化,阴离子如具有强氧化性,可得电子被还原;
D.化合物是否具有强氧化性取决于得电子能力.
解答 解:A.大多数元素的单质由氧化或还原该元素的化合物制得,但不活泼金属元素的单质可由自然界直接得到,故A错误;
B.对于发生歧化反应的物质,氧化剂、还原剂为同一种物质,如氯气和水的反应,氯气既是氧化剂也是还原剂,故B错误;
C.阳离子如处于中间价态,可被氧化,如Fe2+,阴离子如具有强氧化性,可得电子被还原,如NO3-、MnO4-等,故C错误;
D.化合物是否具有强氧化性取决于得电子能力,如CO2中C元素处于最高价态,但氧化性较弱,故D正确.
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重考查学生的分析能力,熟悉氧化还原反应的概念及元素的化合价与离子、物质的性质即可解答,注意利用实例来解答,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 熔沸点高低:CH4<SiH4<GeH4<SnH4 | |
| B. | 离子半径大小:Cl-<Mg2+<O2-<F- | |
| C. | 分散质微粒直径大小:Fe(OH)3胶体>CaCO3悬浊液>NaCl溶液 | |
| D. | 酸性强弱:H2SO4<H3PO4<H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
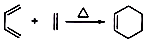 ,
,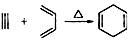 叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )
叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )| A. | 狄尔斯阿德而反应为加成反应,原子利用率为100% | |
| B. | 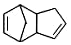 可通过狄尔斯阿德而反应合成,而 可通过狄尔斯阿德而反应合成,而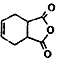 不可通过狄尔斯阿德而反应合成 不可通过狄尔斯阿德而反应合成 | |
| C. | 2-甲基-1,3-丁二烯和丙炔发生上述反应产物有两种 | |
| D. |  可由环戊二烯与丙烯酸甲酯发生上述反应得到 可由环戊二烯与丙烯酸甲酯发生上述反应得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 测定上述实验用的Fe(NO3)3溶液的pH 配制相同pH的稀硝酸 溶液,并将适量此溶液加入有银镜的试管内. | 若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 实验结论 |
| A | 常温下,将大小、形状形态的锌和铝分别加入到等体积98%的浓硫酸中,观察到前者反应速率快 | 锌比铝活泼 |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀 | 该溶液中一定含有SO42- |
| C | 将盐酸滴入碳酸钠溶液中,产生气泡 | 非金属性:Cl大于C |
| D | 向某溶液中加入氢氧化钡溶液丙加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上月考二化学试卷(解析版) 题型:选择题
下列实验现象预测正确的是

A.实验I:振荡后静置,上层溶液颜色保持不变
B.实验II:酸性KMnO4溶液中无明显现象
C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com