
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A. pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B. c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C. c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D. pH=7的溶液中:c(Na+)<2c(C2O42–)
【答案】B
【解析】
A.依据图象可知pH=2.5的溶液中:c(H2C2O4)+c(C2O42﹣)<c(HC2O4﹣);B.依据溶液中电荷守恒和物料守恒分析,c(Na+)=0.100mol/L的溶液中c(H+)+c(H2C2O4)=c(OH﹣)+c(C2O42﹣);C.c(HC2O4﹣)=c(C2O42﹣)的溶液中c(Na+)<0.100 molL﹣1+c(HC2O4﹣);D.pH=7的溶液中,(H+)=c(OH﹣),根据电荷守恒判断。
A.由图象可知,pH=2.5的溶液中c(H2C2O4)和c(C2O42﹣)浓度之和小于c(HC2O4﹣),则c(H2C2O4)+c(C2O42﹣)<c(HC2O4﹣),选项A错误;B.依据溶液中电荷守恒和物料守恒分析,c(Na+)=0.100mol/L的溶液中为NaHC2O4溶液,溶液中存在电荷守恒(H+)+c(Na+)=2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣),物料守恒c(Na+)=c(C2O42﹣)+c(HC2O4﹣)+c(H2C2O4),代入计算得到c(H+)+c(H2C2O4)=c(OH﹣)+c(C2O42﹣),选项B正确;C.c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.100molL﹣1,c(HC2O4﹣)=c(C2O42﹣),电荷守恒(H+)+c(Na+)=2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣),pH约4,此时氢离子浓度大于氢氧根,得到溶液中c(Na+)<0.100 molL﹣1+c(HC2O4﹣),选项C错误;D.pH=7,根据电荷守恒(H+)+c(Na+)=2c(C2O42﹣)+c(OH﹣),因草酸根会水解,所以c(Na+)>2c(C2O42﹣),选项D错误;答案选B。


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等。
(1)如下图所示实验,反应的化学方程式为_______________。实验结束后,向试管所得溶液中滴加酚酞溶液,现象是___________________________。
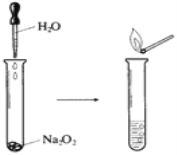
(2)若用嘴通过导管向附着少量Na2O2粉末的棉花吹气,棉花燃烧。原因是Na2O2与H2O和CO2反应,其中与CO2反应的化学方程式为______________________。若标准状况下反应生成了5.6LO2,则转移电子的物质的量为______mol。
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②在第①步的生成的产物中加入30%H2O2,反应生成CaO28H2O沉淀;
③经过陈化、过滤,水洗得到CaO28H2O,再脱水干燥得到CaO2。
完成下列填空:
(3)第①步反应的化学方程式为_____________________。
(4)生产中可循环使用的物质是_____________________。
(5)检验CaO28H2O是否洗净的方法是___________。
(6)已知CaO2在350℃迅速分解生成CaO和O2。如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量是m g,测得气体体积为V mL(标况),产品中CaO2的质量分数为________(用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,产生1.16g白色沉淀。再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。试回答:

(1)写出A点到B点发生反应的离子方程式
(2)C点加入盐酸溶液的体积为 。
(3)原混合物中MgCl2的物质的量是 ,NaOH的质量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用下列装置和操作,能达到实验目的的是

A. 用装置甲分离出溴苯 B. 用装置乙验证乙炔的还原性
C. 用装置丙制取乙烯 D. 用装置丁制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]()
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,HCN中C的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=________________,联氨和N2O4可作为火箭推进剂的主要原因为_________________________________________________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨在水中第一步电离反应的平衡常数值为___________________(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的正盐的化学式为__________________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的正盐的化学式为__________________。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是______________________________。联氨可用于处理高压锅炉水中的氧气,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2___________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于单质硫的叙述中正确的是( )
A.硫的活泼性不如氯气
B.硫在过量纯氧中的燃烧产物是三氧化硫
C.硫与金属单质或非金属单质反应均做氧化剂
D.硫与铁反应产物为Fe2S3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)实验室模拟合成氨和氨催化氧化的流程如下:


(1)N元素在周期表中位置_______________________。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合、干燥,还有______________作用。
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热,锥形瓶中还可观察到的现象是_______________________________________。
(4)写出乙装置中氨氧化的化学方程式:__________________________________________。
(二)实验室探究铜与硝酸反应的相关问题,按下图所示装置进行实验。

请回答下列问题:
(5)装置甲中盛放浓硝酸的仪器A的名称是_______________________。
(6)实验过程中,装置丙中出现的现象是:________________________________________。
(7)装置丙中的试管内发生反应的离子方程式为:__________________________________。
取下装置丙中的试管D,在其中滴加FeSO4溶液,再滴加KSCN溶液,溶液变为______________色。
(8)待反应停止后,Cu片有剩余,取下B,加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,离子方程式为________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。则下列说法不正确的是
FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。则下列说法不正确的是
A. 该反应的平衡常数表达式为K=c(CO)/c(CO2)
B. 该反应的逆反应是放热反应
C. v正(CO2)=v逆(CO)时该反应达到平衡状态
D. c(CO2):c(CO)=1:1时该反应达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com