
| A.1 L水中含有1 mol NaCl | B.溶液中含有1 mol NaCl |
| C.1 L溶液中含有58.5 g NaCl | D.将58.5 g NaCl溶于1 L水中所得的溶液 |
科目:高中化学 来源:不详 题型:计算题
 2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为_____。
2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为_____。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.12.0g熔融的NaHSO4中含有的阳离子数为0.1NA |
| B.常温下,5.6gFe投入到足量浓硝酸中,转移电子数为0.3 NA |
| C.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2 NA |
| D.足量的锌与一定量的浓硫酸反应生成1 mol气体时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol | B.10mol | C.0.5mol | D.0.05mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.263 mol | B.0.483 mol | C.0.663 mol | D.0.893 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,22.4 L O3含有分子的数目为NA |
| B.常温常压下,4.0 g CH4中含有共价键的数目为NA |
| C.常温常压下,1 L 0.1 mol/LNH4NO3溶液中NH4+、NO3-的数目均为0.1 NA |
| D.标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
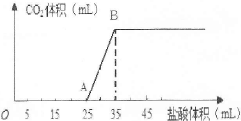
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com