
下列有关氯元素及其化合物的表示正确的是
A.质子数为17、中子数为20的氯原子: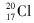
B.氯离子(Cl-)的结构示意图:
C.氯分子的电子式: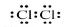
D.氯乙烯分子的结构简式:H3C-CH2Cl
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年福建省高一上学期半期考试化学试卷(解析版) 题型:填空题
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
族 周期 | I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)请从上表中查出关于硼元素的一条信息:_____________________。
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的 相同。
(3)第11号元素与第17号元素组成的化合物是 ,构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。
(4)下图A、B、C是三种粒子的结构示意图.试回答下列问题:
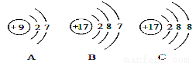
①A、B、C中属于同种元素的粒子是 ;
②A和B两种粒子的 相同,所以它们具有相似的化学性质;
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:实验题
(12分)某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验.
方案Ⅰ.甲组同学用质量法,按如下图所示的实验流程进行实验:

(1)实验时,蒸发结晶操作中,除了酒精灯外,还要用到的仪器是
(2)有同学认为“加入适量盐酸”不好操控,应改为“过量盐酸”,便于操作且不影响测定的准确性,你认为对或错 ,为什么
(3)若实验中测得样品质量为46.4g,固体质量为40.95g,则碳酸钠的质量分数为 .(保留3位有效数字)
(4)蒸发结晶过程中若有固体飞溅,测得碳酸钠的质量分数 (填偏大 偏小 无影响).
方案Ⅱ:乙组同学的主要实验流程图如下:
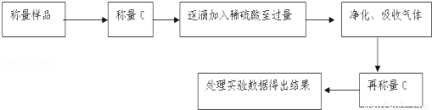
按如下图所示装置进行实验:
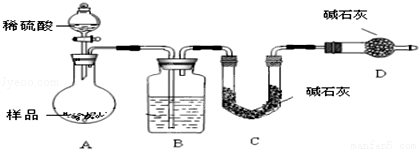
(5)在C中装碱石灰来吸收净化后的气体.D装置的作用是 .
(6)有的同学认为为了减少实验误差,在反应前后都通入N2,反应后通入N2的目的是 .
方案Ⅲ:气体分析法
(7)把一定量样品与足量稀硫酸反应后,用如图装置测量产生CO2气体的体积,B溶液最好采用 (以下选项中选择)使测量误差较小.
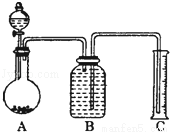
A.饱和碳酸钠溶液 B.饱和碳酸氢钠溶液
C.饱和氢氧化钠溶液 D.饱和硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省绥化市高三上学期期中测试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.10 L 0.l mol?L-1的Na2CO3溶液中离子总数一定大于3NA
B.标准状况下,22.4 L HF的分子数为NA
C.1 mol Fe在22.4 L的Cl2(标准状况下)中燃烧,转移的电子总数为3NA
D.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3 。
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:
 ClO3-+
ClO3-+ Fe2++
Fe2++  =
=  Cl-+
Cl-+  Fe3++
Fe3++  .
.
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
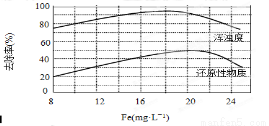
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月阶段测化学试卷(解析版) 题型:选择题
已知:11P+15 CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,有关该反应的下列说法中正确的是
A.氧化剂和还原剂的物质的量之比为15:11
B.上述反应中转移电子的总数为15
C.Cu3P既是氧化产物又是还原产物
D.1molCuSO4参加反应时,转移电子2mol
查看答案和解析>>
科目:高中化学 来源:2016届浙江省瑞安市四校高三上学期第一次联考化学试卷(解析版) 题型:选择题
在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是
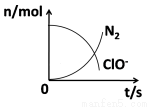
A.还原剂是含CN-的物质,氧化产物只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.配平后氧化剂与还原剂的化学计量数之比为4:1
D.标准状况下,若生成2.24LN2,则转移电子数为NA
查看答案和解析>>
科目:高中化学 来源:2016届湖南省益阳市高三上学期第三次模拟化学试卷(解析版) 题型:选择题
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
V3++ VO2++H2O VO2++2H++V2+ 下列说法正确的是
VO2++2H++V2+ 下列说法正确的是
A.放电时每转移2mol电子时,消耗1mol氧化剂
B.放电时正极反应为:VO+2+2H++e—=VO2++H2O
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区移向阳极区迁移
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上期中测试化学试卷(解析版) 题型:选择题
将一定体积密度为1.3g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止。己知反应后所得溶液的质量等于原BaCl2溶液的质量,则原硫酸溶液浓度为
A.33.9% B.31.0% C.6.65 mol/L D.5.58 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com