
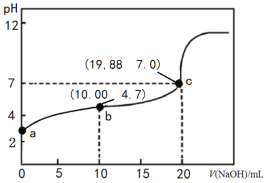
【题目】298K时,向20 mL 0.1000 mol·L-1 CH3COOH溶液中滴入0.1000 mol·L-1NaOH溶液,滴定曲线如图所示(忽略温度变化)。下列说法正确的是
A.该滴定过程应该选择石蕊溶液做指示剂
B.由c点数值可求醋酸的电离平衡常数为1.66×10-5 mol·L-1
C.b点溶液中各微粒浓度关系为2c(H+)+c(CH3COOH) =c(CH3COO-)+2c(OH-)
D.中和同体积同pH的醋酸和盐酸所用氢氧化钠的物质的量,后者多
【答案】BC
【解析】
A.由图可知,醋酸和氢氧化钠中和滴定的滴定终点为碱性,而石蕊的变色pH范围为5~8,不选其做指示剂,应选用酚酞做指示剂,A选项错误;
B.c点时,溶液呈中性,则有c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(Na+)=c(CH3COO-)=![]() mol/L,c(CH3COOH)=
mol/L,c(CH3COOH)= ![]() mol/L,故醋酸的电离平衡常数
mol/L,故醋酸的电离平衡常数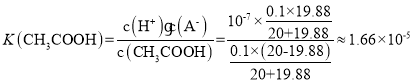 ,B选项正确;
,B选项正确;
C.b点时的溶质为等量的CH3COOH和CH3COONa,存在着质子守恒2c(H+)+c(CH3COOH) =c(CH3COO-)+2c(OH-),C选项正确;
D.由于醋酸是弱电解质,在水溶液中部分电离,则相同体积、相同pH的醋酸和盐酸溶液前者物质的量更大,故中和同体积同pH的醋酸和盐酸所用氢氧化钠的物质的量,前者多,D选项错误;
答案选BC。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】T℃时,分别向10 mL浓度均为0.1 mol·L-1的CuCl2和ZnCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lgc(Cu2+)和-lgc(Zn2+)与Na2S溶液体积(V)的关系如图所示[已知:Ksp(ZnS)>Ksp(CuS),lg3≈0.5]。下列有关说法错误的是( )。
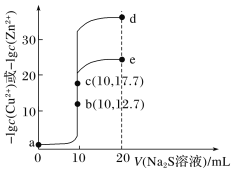
A.a~b~d为滴定ZnCl2溶液的曲线
B.对应溶液pH:a<b<e
C.a点对应的CuCl2溶液中:c(Cl-)<2[c(Cu2+)+c(H+)]
D.d点纵坐标约为33.9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.26gC2H2与C6H6混合气体中含σ键的数目为3NA
B.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
C.电解精炼铜时,当电路中转移NA个电子,阴极析出32 g铜
D.标准状况下11.2 LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国学者研究出一种用于催化 DMO 和氢气反应获得 EG 的纳米反应器,如图是反应的微观过程示意图。下列说法不正确的是
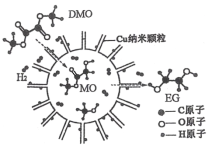
A.Cu纳米颗粒是一种胶体,能将氢气解离成氢原子
B.EG能发生聚合反应生成高分子
C.1molDMO完全转化为EG时消耗2molH2
D.催化过程中断裂的化学键有 H—H、C—O、C=O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同金属在其不同浓度盐溶液中可形成浓差电池。如下图所示装置是利用浓差电池电解Na2SO4溶液(a、b电极均为石墨电极),可以制得O2、H2、H2SO4和NaOH。下列说法不正确的是
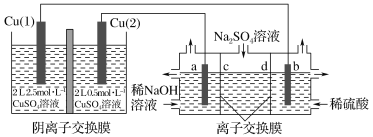
A.a电极的电极反应为4H2O+4e-=2H2↑+4OH-
B.c、d离子交换膜依次为阳离子交换膜和阴离子交换膜
C.电池放电过程中,Cu(1)电极上的电极反应为Cu2++2e-=Cu
D.电池从开始工作到停止放电,电解池理论上可制得320gNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。
(1)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
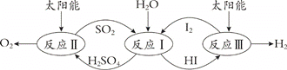
已知:
反应I:SO2(g) + I2(g) + 2H2O(l) = 2HI(aq) + H2SO4(aq) ΔH1=﹣213 kJ·mol-1
反应II:H2SO4(aq) = SO2(g) + H2O(l) +1/2O2(g) ΔH2= +327 kJ·mol-1
反应III:2HI(aq) = H2(g) + I2(g) ΔH3= +172 kJ·mol-1
则反应2H2O(l) = 2H2(g)+O2(g) ΔH= ________。
(2)H2S可用于高效制取氢气,发生的反应为2H2S(g)S2(g)+2H2(g)。
Ⅰ.若起始时容器中只有H2S,平衡时三种物质的物质的量与裂解温度的关系如图:
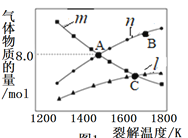
①图中曲线1表示的物质是________________(填化学式)。
②A点时H2S的转化率为__________________。
③C点时,设容器内的总压为pPa,则平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
II.若在两个等体积的恒容容器中分别加入2.0mol H2S、1.0mol H2S,测得不同温度下H2S的平衡转化率如图所示:
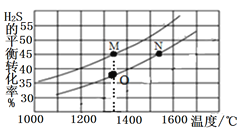
①M点和O点的逆反应速率v(M)______v(O) (填“>”“<”或“=”,下同);
②M、N两点容器内的压强2P(M)_____P(N),平衡常数K(M)_____K(N)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖B. 可采取分液的方法分离乙醇和水
C. 可用碘水检验淀粉是否完全水解D. 葡萄糖可以在酒曲酶作用下分解生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前认为酸催化乙烯水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列说法正确的是

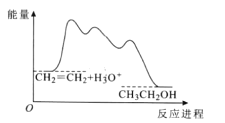
A.①、②、③三步反应均释放能量
B.该反应进程中有两个过渡态
C.第①步反应的活化能最小
D.总反应速率由第①步反应决定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com