
������һ�ּ��߷�չDZ���������Դ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч������Ⱦ�����ⷽ�����䷴Ӧ��������ͼ��ʾ��
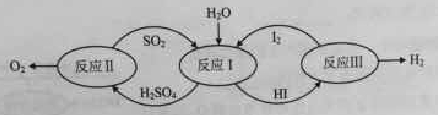
��1����Ӧ��Ļ�ѧ����ʽ�ǡ�
��2����Ӧ��õ��IJ�����I2���з��롣�ò������Һ�ڹ���I2�Ĵ����»�ֳ����㡪������Ũ��I2��H2SO4���Ũ�ȵ�I2��HI�㡣
�ٸ���������ʵ������˵����ȷ���ǣ�ѡ����ţ���
a��������Һ���ܶȴ��ڲ���
b����I2ǰ��H2SO4��Һ��HI��Һ������
c��I2��HI��Һ�б���H2SO4��Һ������
�ڱ��������Һ�ķ����ǡ�
�۾���⣬H2SO4����c(H+)��c(SO42-)=2.06��1�����ֵ����2��ԭ���ǡ�
��3����Ӧ��2H2SO4��l��=2SO2(g)+O2(g)+2H2O(g) ��H=+550kJ/mol
����������Ӧ��ɣ�i H2SO4��l��=SO3(g) +H2O(g) ��H=+177kJ/mol
 ii SO3(g)�ֽ⡣
ii SO3(g)�ֽ⡣
L��L1��L2����X�ɷֱ����ѹǿ���¶ȡ���ͼ��ʾLһ��ʱ��ii��SO3(g)��ƽ��ת������X�ı仯��ϵ��
��X�������������ǡ�
���ж�L1��L2�Ĵ�С��ϵ�����������ɣ���
���𰸡�
��1��SO2 + 2H2O + I2 = H2SO4 + 2HI
��2���� a��c
�� ȡ�ϲ���Һ���Թ��У����������ữ���Ȼ�����Һ�������ְ�ɫ���������ϲ���ҺΪ����Ũ�� I2 �� H2SO4��Һ�����������������ϲ�Ϊ����Ũ�� I2 �� HI �㡣�������������۲���Һ��ɫ����ɫ���Ϊ����Ũ�� I2 �� HI �㣩
�� �ⵥ�ʿ���ˮ������Ӧ I2 + H2O ⇌ HI +HIO��c(H+)����ʹ��Һ�� c(H+):c(SO42-)�ı�ֵ���� 2
��3���� ѹǿ
�� L2>L1 L�����¶ȶ� SO3��ƽ��ת���ʵ�Ӱ�죬��Ӧ��Ϊ���ȷ�Ӧ���¶����� SO3ת��������
��������(1) ����ͼ����Ϣ��֪��Ӧ���з�Ӧ��Ϊ SO2��H2O �� I2��������Ϊ H2SO4�� HI����ƽ����SO2 + 2H2O + I2 = H2SO4 + 2HI��(2)�� ���ʿ�����������Ϣ���ò������Һ�ڹ��� I2 �Ĵ����»�ֳ����㡪������Ũ�� I2�� H2SO4 ��ͺ���Ũ�� I2 �� HI �㡱�ķ����������������� I2 ǰ��Һδ���ֲַ㣬����I2 ���� HI ��Һ���ܽ�ȴ����� H2SO4��Һ���ܽ�ȣ�����Һ���ܶȴ��ڲ��죬�ʳ��ֲַ����� ���ʿ��鳣������ SO42-�ļ��顣�� �������Ϣ��֪ H2SO4��Һ�����е�Ũ�ȵĵ⣬�ⵥ�ʿ���ˮ������Ӧ I2 + H2O ⇌ HI +HIO��c(H+)����ʹ��Һ�� c(H+):c(SO42-)�ı�ֵ���� 2 ��(3)Ӱ�컯ѧ��Ӧƽ�����غ�ͼ���ۺ����⡣����Ҫ���ݷ�Ӧ��Ͳ��袡д�����袢���Ȼ�ѧ��Ӧ����ʽ 2SO3��g��= 2SO2��g��+O2��g�� ��H=+196 KJ∙mol-1���� �÷�Ӧ����ӦΪ�����������ķ�Ӧ��ѹǿ����ƽ�������ƶ���SO3��ת���ʼ�С�� X ������������Ϊѹǿ���� ���ݢ��ʿ�֪ L ������������Ϊ�¶ȡ��÷�Ӧ������ӦΪ���ȷ�Ӧ����ͬѹǿʱ���¶����ߣ�ƽ�������ƶ���SO3��ת�������� L2>L1��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ͼ��ʾ������ˮ��ɲ���ij�л�������A��A�ڲ�ͬ�������������£���������B(C6H12O7)��C(C6H10O8)��B��C�����ܷ���������Ӧ��A��B��C�����Ա�ǿ��ԭ����ԭ��ΪD(C6H14O6)��B��ˮ�ɵ���Ԫ�����������E����Ԫ�����������F����֪��������ʱ����������״����ǣ�RCHO���ף�R��CH2OH��֮��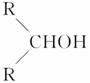 ���ѡ�
���ѡ�
�������пո�����дA��B��C��D��E��F�Ľṹ��ʽ��
A��____________________��B.____________________��
C��____________________��D.____________________��
E��____________________��F.____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ˮ�����γɵ���Һ����NH4Cl��Ӧ����NH3����
A���������� B����
C������þ D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������X��Y��Zת����ϵ����ͼ��ʾ�������ж���ȷ����
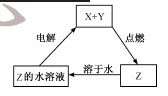 A. X�����ǽ���ͭ
A. X�����ǽ���ͭ
B. Y������������
C. Z�������Ȼ���
D. Z�����Ƕ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й���Ԫ�ؼ��仯����ı�ʾ��ȷ���� �� ��
A.������Ϊ17��������Ϊ20����ԭ�ӣ�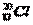
B.�����ӣ� ���Ľṹʾ��ͼ��
���Ľṹʾ��ͼ��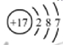
C.�ȷ��ӵĵ���ʽ��
D.����ϩ���ӵĽṹ��ʽ��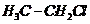
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʯ����Ҫ�ɷ���CaCO3��MgCO3�����ҹ��д����ķֲ�������ʯΪԭ�������ĸ�þϵ�в�Ʒ�й㷺����;������ʯ�����ա��ۻ���õ���þ����������پ���̼��ʵ��Ca2+��Mg2+�ķ��롣̼����Ӧ�Ƿ��ȷ�Ӧ����ѧ����ʽ���£�Ca(OH)2 + Mg(OH)2 + 3CO2⇌ CaCO3 + Mg(HCO3)2 + H2O
����������
Ca(OH)2�ļ��Ա�Mg(OH)2�ļ��� ��ѡ�ǿ����������
Ca(OH)2���ܽ�ȱ�Mg(OH)2���ܽ�� ��ѡ���С����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���н�����ʵ�ķ���ʽ����ȷ����(����)
A����0.1 mol/L��ˮ��pHΪ11��
NH3��H2O NH
NH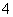 ��OH��
��OH��
B����Na�����ˮ�У��������壺
2Na��2H2O===2NaOH��H2��
C����CuCl2��Һ������ʵ�飬���ݷ��⣺
CuCl2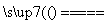 Cu2����2Cl��
Cu2����2Cl��
D��AlƬ����NaOH��Һ�У��������壺
2Al��2OH����2H2O===2AlO ��3H2��
��3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з�Ӧ�У���Ӧ������������ص���(����)
A������ͨ�����ȵ�CuO��ĩ
B��������̼ͨ��Na2O2��ĩ
C������Fe2O3�������ȷ�Ӧ
D����п��Ͷ��Cu(NO3)2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ����ʽ�ɼ���������Ԫ�ؼ��仯��������ʡ���֪��
������ԭ��Ӧ��
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl�� 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2�� + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI�� 3I2 + 6KOH = 5KI + KIO3 + 3H2O
���ֽⷴӦ��
2HSCN + K2CO3 = 2KSCN + CO2 �� + H2O�� KCN + CO2 + H2O = HCN + KHCO3
�ȷֽⷴӦ��
4NaClO  3NaCl + NaClO4��NaClO4
3NaCl + NaClO4��NaClO4  NaCl + 2O2��
NaCl + 2O2��
����˵������ȷ�ǣ�
A�������ԣ�������Һ����FeCl3 > Co(OH)3 > I2
B����ԭ�ԣ�������Һ����Fe(OH)2 > I2 > KIO3
C�����ȶ��ԣ�NaCl > NaClO4 > NaClO
D�����ԣ�ˮ��Һ����HSCN > H2CO3 > HCN
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com