
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法中不正确的是
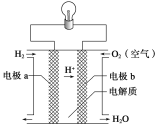
A. 该电池中电极a是正极
B. 外电路中电子由电极b通过导线流向电极a
C. 该电池的正极反应为O2+4H++4e- = 2H2O
D. 该电池的总反应:2H2+O2 = 2H2O
科目:高中化学 来源: 题型:
【题目】碘是人体各个系统特别是神经系统发育所不可缺少的微量元素。海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。某课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间,得到海带灰悬独液,然后按以下实验流程提取单质碘:

(1)灼烧海带时需要用到的实验仪器是___________(填标号)。
A.烧杯 B.蒸发皿 C.坩埚 D.三脚架 E.酒精灯 F.泥三角 G.玻璃棒
(2)图中操作①名称为______,操作③名称为__________。
(3)操作③中所用的有机试剂可以是_________(只填一种),理由是________。
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.拧开漏斗下面的活塞,用烧杯接收下层溶液;
F.从分液漏斗上口倒出上层液体;
G.将分液漏斗上口的玻璃塞打开(或使塞上的凹槽与漏斗上口的小孔对准);
H.静置、分层。
过程③正确操作步骤的顺序是:________(填标号);上述G步操作的目的是:_______。
(5)检验提取碘后的水溶液中是否还含有单质碘的简单方法是_______
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还需要经过蒸馏。观察下图所示实验装置,指出需要改正的地方:_________。

上述蒸馏操作结束后,晶态碘在_________(填仪器名称)里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用;②砹(At)是第ⅦA族,其氢化物的稳定性大于HCl;③Na2FeO4可做水的消毒剂和净化剂;④陶瓷、玻璃、水晶、玛瑙、水泥、光导纤维的主要成分都是硅酸盐;⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应;⑥第三周期金属元素的最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱;⑦海水提镁的主要步骤为:

A. ①③④⑦ B. ①③⑥ C. ③④⑤⑦ D. ②④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)含有6.02×1023个H的H2O,其物质的量是_______;1 mol Na2SO4溶于水能电离出______个Na+。
(2)______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(4)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。
(5)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA
B. 4.6 g NO2和N2O4混合物中含氧原子数为0.3 NA
C. 标准状况下,6.72 L NO2与水反应,转移电子数为0.3 NA
D. 0.1 mol/L NaHCO3溶液中,HCO3-、H2CO3和CO32-总数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫—碘循环分解水制氢主要涉及下列反应:
① SO2+2H2O+I2===H2SO4+2HI ② 2HI![]() H2+I2 ③ 2H2SO4 === 2SO2+O2+2H2O
H2+I2 ③ 2H2SO4 === 2SO2+O2+2H2O
(1)整个过程中SO2、I2的作用是______。
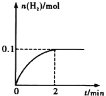
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应②,已知H2的物质的量随时间的变化如图所示,则在0~2 min内的平均反应速率v (HI) =______;
(3)已知拆开1 mol H—I键需要消耗298kJ能量,形成1mol H—H键能够释放436kJ能量,形成1mol I—I键能够释放151kJ能量,则在反应②中,分解0.2mol HI时会______(填“吸收”或“释放”)______kJ能量。
(4)实验室用Zn和硫酸制H2,为了加快反应速率下列措施不可行的是__(填序号)
a.加入浓硝酸 b.加入少量CuSO4 固体 c.用粗锌代替纯锌 d.加热 e.把锌粒弄成锌粉 f.用98.3%的浓硫酸
(5)氢气可用于制燃料电池,某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-== 2H2O ,B极:O2+4e-== 2O2-,则A极是电池的___极;电子从该极___(填“流入”或“流出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O (l) =H2O(g); △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③ 03 min内用CH3OH表示的反应速率v(CH3OH)=________mol L-1·min-1。
④ 200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CO32-、Cl-、OH-、SO42- |
已知:
①常温下A、C溶液pH均大于7,B溶液pH小于7,D溶液pH等于7;
②C溶液和D溶液混合只产生白色沉淀;
③B溶液和C溶液混合共热时只产生刺激性气味的气体;
④A溶液和D溶液混合时无明显现象。
请回答:
(1)D的化学式_______________________。
(2)实验③反应的离子方程式_______________________。
(3)从B、C、D中选取物质,设计实验方案确定A的组成_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲烷分子的比例模型为![]() ,其二氯取代物有2种结构
,其二氯取代物有2种结构
B. 苯和乙烯都能使溴水褪色,其褪色原理相同
C. 相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同
D. 在一定条件下,苯与氯气生成氯苯的反应类型是加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com