
【题目】【题目】烃A的质谱图中,质荷比最大的数值为42。碳氢两元素的质量比为6:1,其核磁共振氢谱有三个峰,峰的面积比为1:2:3。A与其他有机物之间的关系如下:
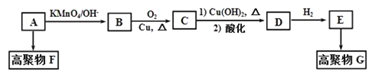
已知:CH2=CH2![]() HOCH2CH2OH,回答下列问题:
HOCH2CH2OH,回答下列问题:
(1)有机物B的分子式___________________________。
(2)高聚物F结构简式为___________________。
(3)写出C与新制的氢氧化铜反应的化学方程式___________________________。
(4)E在一定条件下可以相互反应生成一种六元环有机物H,H的结构简式________.。
(5)写出生成G的化学方程式_____________________________________________;
【答案】 )C3H8O2 ![]()
![]()
 n
n![]()
![]()
![]() +(n-1)H2O
+(n-1)H2O
【解析】试题分析:本题考查有机推断,涉及有机物分子式和结构简式的确定、有机物分子式和结构简式的书写、有机反应方程式的书写。A的质谱图中质荷比最大的数值为42,A的相对分子质量为42,烃A中n(C):n(H)=![]() :
: ![]() =1:2,A的实验式为CH2,A的分子式为(CH2)x,14x=42,解得x=3,A的分子式为C3H6,A的核磁共振氢谱有三个峰且峰的面积比为1:2:3,A的结构简式为CH2=CHCH3。A发生加聚反应生成的高聚物F的结构简式为
=1:2,A的实验式为CH2,A的分子式为(CH2)x,14x=42,解得x=3,A的分子式为C3H6,A的核磁共振氢谱有三个峰且峰的面积比为1:2:3,A的结构简式为CH2=CHCH3。A发生加聚反应生成的高聚物F的结构简式为![]() ;A→B发生题给已知的反应,B的结构简式为
;A→B发生题给已知的反应,B的结构简式为![]() ;B→C发生醇的催化氧化,C的结构简式为
;B→C发生醇的催化氧化,C的结构简式为![]() ;C与Cu(OH)2加热时,C中-CHO被氧化,酸化后得到的D的结构简式为
;C与Cu(OH)2加热时,C中-CHO被氧化,酸化后得到的D的结构简式为![]() ;D与H2发生加成反应生成E,E的结构简式为
;D与H2发生加成反应生成E,E的结构简式为![]() ;E中含羟基和羧基,E发生缩聚反应生成高聚物G,G的结构简式为
;E中含羟基和羧基,E发生缩聚反应生成高聚物G,G的结构简式为![]() 。
。
(1)B的结构简式为![]() ,B的分子式为C3H8O2。
,B的分子式为C3H8O2。
(2)高聚物F的结构简式为![]() 。
。
(3)C的结构简式为![]() ,C与新制Cu(OH)2反应的化学方程式为
,C与新制Cu(OH)2反应的化学方程式为![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O。
+Cu2O↓+3H2O。
(4)E的结构简式为![]() ,2分子E通过酯化反应形成六元环有机物H,H的结构简式为
,2分子E通过酯化反应形成六元环有机物H,H的结构简式为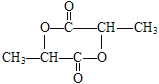 。
。
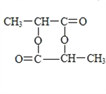
(5)G由E发生缩聚反应生成,生成G的化学方程式为n![]()
![]()
![]() +(n-1)H2O。
+(n-1)H2O。


科目:高中化学 来源: 题型:
【题目】在常温下,铁与水并不起反应,但在高温下,铁与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“铁与水蒸气的反应实验”。
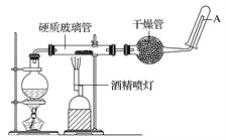
请回答该实验中的问题。
(1)写出该反应的反应方程式:__________________________________;并指明该氧化还原反应的还原剂是____________,氧化剂是______________。
(2)实验前必须对整套装置进行气密性检查,操作方法是_______________________________。
(3)圆底烧瓶中盛装有水,该装置受热后的主要作用是____________________________;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是__________________。
(4)酒精灯和酒精喷灯点燃的顺序是__________________________________,为什么?___________________________________________________________________。
(5)干燥管中盛装的物质是________________________,作用是_______________________。
(6)试管中收集的气体是__________,如果要在A处玻璃管处点燃该气体,则必须对该气体进行____________________,方法是________________________________。这一操作的目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 原子及其离子的核外电子层数等于该元素所在的周期数
B. 零族元素与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布
C. 同周期的X、Y元素,且电负性X>Y,则第一电离能也是X>Y
D. 基态原子p能级上半充满的元素一定位于p区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。请根据装置图回答下列问题:

(1)将A、B、C、D 填入适当的空格中。
①从碘水中提取碘_______;
②分离酒精与水的混合物_______;
③除去粗盐中的泥沙________;
④与海水晒盐原理相符的是_________;
(2)装置A中仪器①的名称是_________________,冷却水是从______口进水(填“下”或“上”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用0.4molL﹣1 NaOH溶液480mL.配制方法如下:
(1)配制该溶液所需的仪器有:量筒、天平、药匙、烧杯、玻璃棒、___、_____;
(2)用托盘天平准确称量___________g 固体NaOH;
(3)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是_________,对实验结果没有影响的是_____________(填各选项的序号).
A.所用的NaOH中混有少量Na2O
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,仰视容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO47H2O的一种流程如图:

(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______________。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________________。
(4)步骤Ⅲ中,加入锌粉的作用是______________。
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从硫酸锌溶液中获得硫酸锌晶体的实验操作为________________、冷却结晶、过滤。烘干操作需在减压低温条件下进行,原因是_________________________________。
(6)取28.70 g ZnSO47H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680℃时所得固体的化学式为______。

a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,并回答下列问题。
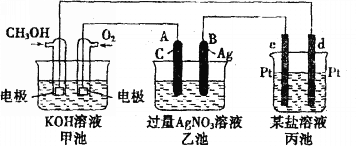
(1)甲池是_________池,通入CH3OH(甲醇)的电极作为_______极,电极反应式为________________________________________________。
(2)乙池是________池,A电极名称为______极,电极反应式为_______________________,乙池中的总反应化学方程式为________________________________,溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当甲池中消耗O2 0.56L(标准状况下)时,理论上乙池中B极的质量增加_______g;此时丙装置中_____________(填“c”或“d”)电极析出1.20g金属,则丙装置中的某盐溶液可能是________(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com