
A、B、C、D、E、F、G、L、I九种主族元素分别位于三个不同的短周期,它们的原子序数依次增大,其中B、C、D位于同一周期,A与E、B与G、D与L分别位于同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)__________________________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)____________。
(2)L、I两元素可按原子个数比1∶1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为__________________________________________。
(3)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式:__________________________________________________________。
(4)由A、B、C、D按原子个数比4∶1∶1∶2形成一种化合物Y,则Y的化学式为________________________,向Y中加足量稀硫酸后,再加高锰酸钾溶液,高锰酸钾溶液褪色。写出使高锰酸钾溶液褪色的反应的离子方程式:____________________________。
答案 (1)SiH4 S2->Na+>Al3+
(2) 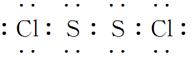
(3)Na2O2+S2-+2H2O===S↓+2Na++4OH-
(4)(NH4)2C2O4 2MnO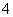 +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
解析 由于九种主族元素位于三个不同的周期,而B、C、D位于同一周期,可以知道A为氢元素,B、C、D位于第二周期,E、F、G、L、I则位于第三周期;由A与E为同一主族元素,可确定E为钠元素;由F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,可推知D、F为氧元素和铝元素;由C、D、F三种元素的原子序数之和为28,可推知C元素为氮元素;由D与L位于同一主族,可推知L为硫元素;由其原子序数关系和B与G位于同一主族可知,I只能是氯元素,B、G分别为碳元素和硅元素。即A、B、C、D、E、F、G、L、I分别对应H、C(碳)、N、O、Na、Al、Si、S、Cl。(1)题述非金属元素除H外,C(碳)、N、O、Si、S、Cl中硅元素的非金属性最弱,故形成的最简单的气态氢化物中SiH4的稳定性最弱。E、F、L所形成的简单离子中S2-与氩原子的核外电子排布相同,而Na+和Al3+则与氖原子核外电子排布相同,故离子半径大小顺序为S2->Na+>Al3+。(2)L、I两元素按原子个数比1∶1组成的化合物应该是S2Cl2,其中硫原子和硫原子之间、硫原子和氯原子之间均以共价单键的形式结合。(3)Na2O2和Na2S的水溶液发生氧化还原反应,生成NaOH,同时有S沉淀析出。(4)由A、B、C、D按原子个数比4∶1∶1∶2形成的化合物为(NH4)2C2O4。C2O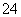 具有还原性,能够被酸性KMnO4溶液氧化,反应的离子方程式为2MnO
具有还原性,能够被酸性KMnO4溶液氧化,反应的离子方程式为2MnO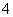 +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
在BaCl2溶液中通入SO2气体,未见沉淀生成,若再通入下列四种气体①Cl2 ②NH3 ③NO2 ④H2S均会产生沉淀。
回答下列问题:
(1)通入四种气体时产生的沉淀分别是
①______________;②_____________;③_____________;④_____________。
(2)用方程式表示①和④产生沉淀的原因
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①为纪念著名天文学家哥白尼,国际纯粹与应用化学联合会将112号元素的符号定为“Cn”,汉语名为“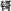 ”;②合理利用核能符合“低碳经济”的要求,
”;②合理利用核能符合“低碳经济”的要求,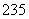 92U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6,还含有FeO、MgO、CaO等杂质)。下列有关叙述对上述所涉及元素的说法正确的是( )
92U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6,还含有FeO、MgO、CaO等杂质)。下列有关叙述对上述所涉及元素的说法正确的是( )
A.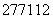 Cn的原子核内中子数与核外电子数之差为55
Cn的原子核内中子数与核外电子数之差为55
B.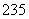 92U和
92U和 92U是同位素,核反应属于化学变化
92U是同位素,核反应属于化学变化
C.40Ca2+与18O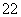 具有相同的电子数
具有相同的电子数
D.Si2O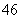 中质子总数为80
中质子总数为80
查看答案和解析>>
科目:高中化学 来源: 题型:
在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法正确的是( )
A.34S原子核内中子数为16
B.16O2比18O2沸点更低
C.2H+的酸性比1H+的酸性更强
D.13C和15N原子核内的质子数相差2
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为短周期主族元素,其核电荷数依次增大,且它们的原子最外层电子数之比为1∶4∶2。下列叙述中正确的是( )
A.X一定是碱金属元素
B.Y元素能形成化合物NaHYO3,且其水溶液呈碱性
C.Z元素形成的最高价氧化物熔点较高
D.X的单质一定能通过电解Z的盐酸盐溶液制备
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车排放的尾气中含有NO2,NO2是城市大气污染的主要污染物之一,在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2—→2NO+2O,②2NO+O2—→2NO2,③O+O2—→O3。下列对该反应过程及生成物叙述正确的是( )
A.NO2起催化剂作用 B.NO起催化剂作用
C.NO2只起氧化剂作用 D.O3与O2为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关硝酸化学性质的叙述中,正确的是( )
A.浓、稀硝酸都能使蓝色石蕊试纸最终变为红色
B.硝酸能与FeO反应,只表现氧化性
C.硝酸可与Na2S反应制得H2S气体
D.浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
2014高考涉及氮及化合物选项正误判断,正确的划“√”,错误的划“×”
(1)Cu溶于稀HNO3的离子方程式为Cu+2H++NO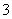 ===Cu2++NO2↑+H2O( )
===Cu2++NO2↑+H2O( )
(2014·江苏,7A)
(2)NH3、O2和HNO3三种物质中,任意两种物质在一定条件下均能发生反应( )
(2014·江苏,8B)
(3)NH3能使酚酞溶液变红,因而NH3可用于设计喷泉实验( )
(2014·广东理综,9C)
(4)将可调高度的铜丝伸入稀HNO3中,溶液变蓝,则Cu与稀HNO3发生置换反应( )
(2014·广东理综,22C)
(5)实验室用锌粒、稀HNO3以及试管、带导管的橡皮塞可制取H2( )
(2014·安徽理综,9C)
(6)由于反应物浓度越大,反应速率越快,因而常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完( )
(2014·安徽理综,12B)
(7)制二氧化氮时,用水或NaOH溶液吸收尾气( )
(2014·天津理综,2D)
(8)用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2( )
(2014·重庆理综,2B)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂方法正确的是( )
A.除去乙烷中少量的乙烯:通入H2,加催化剂反应
B.除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
C.除去乙醇中少量的乙酸:加足量生石灰,蒸馏
D.只含有泥沙的粗盐:可通过溶解、过滤、蒸发、结晶的方法提纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com