
| A. | 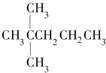 | B. | CH3CH2CH2CH2CH3 | C. | 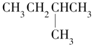 | D. | 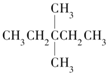 |
分析 该饱和烷烃在光照的条件下与氯气反应能生成4种不同的一氯取代物,说明该饱和烷烃中含有4种类型的氢原子;
氧气的物质的量=$\frac{246.4L}{22.4L/mol}$=11mol,根据饱和烷烃燃烧的通式和题干中1mol烃燃烧时的耗氧量,确定烃的化学式.
解答 解:该饱和烷烃在光照的条件下与氯气反应能生成4种不同的一氯取代物,说明该饱和烷烃中含有4种类型的氢原子;
氧气的物质的量=$\frac{246.4L}{22.4L/mol}$=11mol,设该饱和烷烃的通式为CxH 2x+2,1mol某饱和烷烃在氧气中充分燃烧,需要消耗氧气的物质的量=(x+$\frac{2x+2}{4}$)mol=11mol,x=7,所以该饱和烷烃是庚烷且含有4种类型的氢原子,
故选A.
点评 本题考查考生对有机化学分子式、结构式、等价氢、燃烧方程式等知识的掌握,难点是判断等效氢原子,根据对称结构判断即可,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
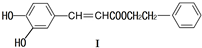 在药物、涂料等领域应用广泛.
在药物、涂料等领域应用广泛.
 ;反应类型:水解(取代)反应
;反应类型:水解(取代)反应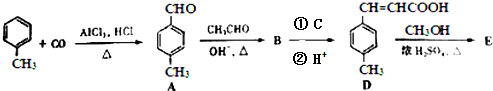
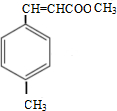 .
.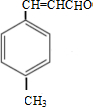 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$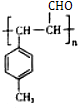 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
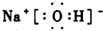 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 第一组 | He | -268.8 | (a) | -249.5 | Ar | -185.8 | Kr | -151.7 |
| 第二组 | F2 | -187.0 | Cl2 | -33.6 | (b) | 58.7 | I2 | 184.0 |
| 第三组 | (c) | 19.4 | HCl | -84.0 | HBr | -67.0 | HI | -35.3 |
| 第四组 | H2O | 100.0 | H2S | -60.2 | (d) | -42.0 | H2Te | -1.8 |
| A. | abc的化学式分别为Ne2、Br2、HF | |
| B. | 第三组与第四组相比较,化合物的稳定顺序为:HBr<d | |
| C. | 第三组物质溶于水后,溶液的酸性c最强 | |
| D. | 第四组物质中H2O的沸点最高,是因为H2O分子内存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
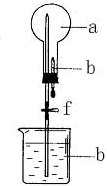 在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b不满足题目要求的是( )
在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b不满足题目要求的是( )| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/LNaOH溶液 |
| C | Cl2 | 饱和NaOH溶液 |
| D | NH3 | 1mol/L盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑥ | C. | ④⑤⑥ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某元素基态原子的电子排布图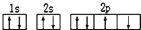 | |
| B. | NH4Cl电子式为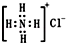 | |
| C. | Ca2+离子基态电子排布式为1s22s22p63s23p6 | |
| D. | 钾(K)的原子结构示意图为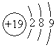 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com