
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H=-Q kJ/mol(Q>0) |
分析 反应过程中醋酸逐渐凝固,说明HCl和NH4HCO3反应过程中温度降低,则该反应是吸热反应,反应物的总能量低于生成物的总能量,以此解答该题.
解答 解:A.醋酸逐渐凝固,说明反应吸收热量导致醋酸溶液温度降低,即NH4HCO3与HCl的反应为吸热反应,故A错误;
B.该反应为吸热反应,即吸收的热量转化为产物内部的能量,故B正确;
C.因反应为吸热反应,则反应物的总能量低于生成物的总能量,故C错误;
D.书写热化学方程式时,应注明物质的状态,因反应为吸热反应,所以焓变大于0,正确的热化学方程式为:NH4HCO3(g)+HCl(aq)=NH4Cl(aq)+CO2↑(g)+H2O(l)△H=Q kJ/mol(Q>0),故D错误.
故选B.
点评 本题考查化学反应能量变化判断、热化学方程式书写方法,为高频考点,注意掌握反应过程中的能量变化与反应物、生成物总能量的关系,明确吸热反应与放热反应的区别及判断方法.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:填空题
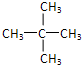 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,D元素位于周期表中的位置第三周期第ⅤⅡA族.
,D元素位于周期表中的位置第三周期第ⅤⅡA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论 |
1向盛放溶液的试管中加入足量HNO3. | 有气泡产生 | 证明有CO32-. |
2继续向试管中加入足量Ba(NO3)2溶液 | 有白色沉淀生成 | 证明有SO42-. |
3过滤,向滤液中加适量的AgNO3溶液 | 有白色沉淀生成 | 证明有Cl-. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
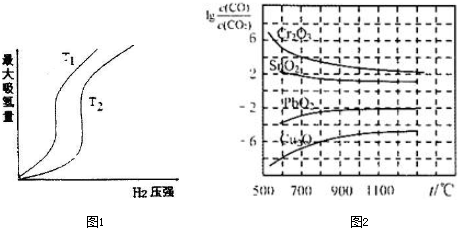
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比($\frac{{P}_{后}}{{P}_{前}}$) | 0.98 | 0.90 | 0.78 | 0.66 | 0.66 | 0.66 |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
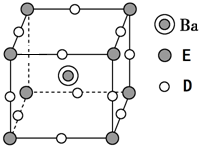 有原子序数依次增大的A、B、C、D、E、F、G 七种元素,A 是短周期中族序数等于周期数的非金属元素;B 元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;D 的最外层电子数与电子层数之比为3:1;E是地壳中含量第二多的非金属元素;D、F同族; G 元素原子序数为24.
有原子序数依次增大的A、B、C、D、E、F、G 七种元素,A 是短周期中族序数等于周期数的非金属元素;B 元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;D 的最外层电子数与电子层数之比为3:1;E是地壳中含量第二多的非金属元素;D、F同族; G 元素原子序数为24.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水鉴别MgCl2溶液和AlCl3溶液 | |
| B. | 用二氧化碳鉴别CaCl2溶液和NaCl溶液 | |
| C. | 用铁片鉴别稀H2SO4和浓H2SO4 | |
| D. | 用相互滴加的方法鉴别NaHCO3溶液和Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )
键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )| A. | 1-己烯 | B. | 2-己烯 | C. | 3-已烯 | D. | 2-甲基-2-戊烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com