
| A. | 1 mol K2O2中含有的阴、阳离子总数是4NA | |
| B. | 0.2molO3与6.72LO2均含有0.6NA个氧原子 | |
| C. | 常温常压下,22g P4O6与P4O10的混合物中含有氧原子的数目为0.6NA | |
| D. | 10gD216O所含的中子数为5NA |
分析 A、K2O2由2个钾离子和1个过氧根构成;
B、氧气所处的状态不明确;
C、P4O6与P4O10中氧元素的百分含量不同;
D、求出D216O的物质的量,然后根据D216O中含10个中子来分析.
解答 解:A、K2O2由2个钾离子和1个过氧根构成,故1mol过氧化钾中含阴阳离子共3NA个,故A错误;
B、氧气所处的状态不明确,故6.72L氧气的物质的量无法计算,则含有的氧原子的个数无法计算,故B错误;
C、P4O6与P4O10中氧元素的百分含量不同,故22g混合物中含有的氧原子的质量和P4O6与P4O10的比例有关,故含有的氧原子的物质的量和均无法计算,故C错误;
D、10gD216O的物质的量为0.5mol,而D216O中含10个中子,故0.5mol重水中含5NA个中子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用C8H18萃取溴水中的溴,可观察到溶液分层,上层为橙红色,下层接近无色 | |
| B. | 有机物一定含碳、氢元素,可能含有氧、硫等元素 | |
| C. | 在石油的分馏实验中,温度计的水银球插入石油中以测液体的温度 | |
| D. | 石油的裂化、裂解、分馏与煤的干馏均属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的H2S和PH3含有相同的原子数 | |
| B. | NH3的摩尔质量为17 | |
| C. | 9.03×1023个CO2分子的质量为66g | |
| D. | 同温同压下,相同体积的物质,其物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
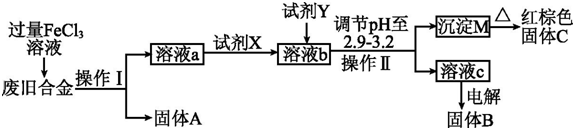
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4molA+2molB | B. | 1.5molC+0.5molD | ||
| C. | 1molB+1molD | D. | 1molA+0.5molB+1.5molC+0.5molD |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
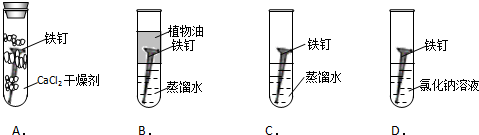
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com