
下列鉴别方法可行的是 ( )
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO3-和CO3-
C.用核磁共振氢谱鉴别1溴丙烷和2溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH CHCH2OH和CH3CH2CH2CHO
CHCH2OH和CH3CH2CH2CHO
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:

| 分子式 | 丙 C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
(1)甲中含氧官能团的名称为________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
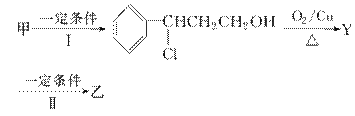
其中反应Ⅰ的反应类型为________,反应Ⅱ的化学方程式为__________________________(注明反应条件)。
(3)已知:RCH===CHR′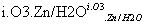 RCHO+R′CHO;
RCHO+R′CHO;
2HCHO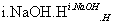 HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
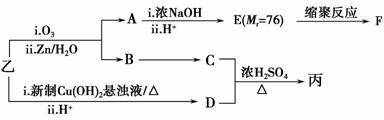
①下列物质不能与C反应的是________(选填序号)。
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②写出F的结构简式_______________________。
③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式________。
a.苯环上连接三种不同官能团
b.能发生银镜反应
c.能与Br2/CCl4发生加成反应
d.遇FeCl3溶液显示特征颜色
④综上分析,丙的结构简式为_________________。
⑤写出乙与新制的Cu(OH)2悬浊液反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期元素,核电荷数依次增加。只有E为金属,A与E同主族,B与F同主族,B原子最外层电子数是内层电子数的2倍,D最外层有两对成对电子。E+与C3-具有相同的电子层结构。请回答下列问题:
(1)F的价电子排布为______。
B、F形成的化合物晶体类型是_____。
(2)A、B、C、D形成的既有离子键又有共价键的化合物化学式为______。
(3)A、C形成的分子有_____对孤对电子、_____个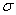 键,中心原子杂化方式为______。
键,中心原子杂化方式为______。
(4)稳定性:CA3_____FA4。离子半径:E+_______C3-。(填“>”或“<”
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是: ( )
A.乙酸与碳酸钠溶液反应:2H++CO32- ==CO2↑+H2O
B.向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-== CaCO3↓+H2O
C.苯酚钠溶液中通人少量二氧化碳:2C6H5O-+CO2+H2O== 2C6H5OH+CO32-
D.过氧化氢溶液滴入硫酸酸化的碘化钾溶液中:H2O2+2I-+2H+ ===I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途。)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。干法、湿法制备高铁酸盐的原理如下表所示。
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
(1) 干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH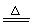 2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。请完成FeO42-与水反应的方程式:4FeO42-+10H2O  4Fe(OH)3+8OH-+( )
4Fe(OH)3+8OH-+( )
(3)K2FeO4在处理水的过程中能消毒杀菌是因为① ,
它能净水的原因是② 。
(4) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
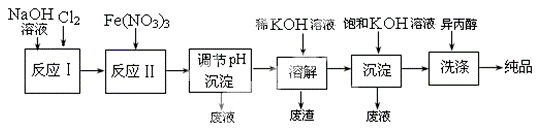
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是 ( )
A. MnO2 与浓盐酸反应制Cl2: MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. 明矾溶于水产生Al(OH)3 胶体: Al3++3H2O Al(OH)3↓+3H+
Al(OH)3↓+3H+
C. Na2O2 溶于水产生O2: Na2O2+H2O 2Na++2OH-+O2↑
2Na++2OH-+O2↑
D. Ca(HCO3)2溶液与少量NaOH溶液反应: HCO3-+Ca2++OH- CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是( )
A.H2O(g)===H2+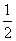 O2(g) ΔH=-485 kJ·mol-1
O2(g) ΔH=-485 kJ·mol-1
B.H2O(g)===H2(g)+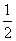 O2(g) ΔH=+485 kJ·mol-1
O2(g) ΔH=+485 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,有错误的是
A. Na2CO3比NaHCO3容易溶解于水
B. 将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈
C. Na2CO3很稳定,而NaHCO3受热时容易分解
D. Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是
A.分子中都含有σ键和π键
B.中心原子都sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有
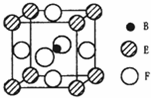 (5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com