
分析 (1)平衡常数只与温度有关,升高温度平衡向吸热方向移动;
(2)所得混合溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(OH- )═c(H+);根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$;
(3)CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液铵根离子和醋酸根离子水解程度相同,导致醋酸铵溶液呈中性;水的电离程度很小,据此判断离子浓度大小;
(4)根据亚硫酸第一步电离平衡常数计算亚硫酸浓度;
(5)$\root{3}{\frac{{K}_{sp}[Fe(OH)_{3}]}{0.1}}$≤c(OH- )<$\sqrt{\frac{{K}_{sp}[Mg(OH)_{2}]}{0.1}}$.
解答 解:(1)a.平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,所以它们都能反映一定条件下对应变化进行的程度,故正确;
b.升高温度平衡向吸热方向移动,如果化学平衡正反应是放热反应,则升高温度化学平衡常数减小,故错误;
c.电离平衡常数只与温度有关,温度相同电离平衡常数相同,故错误;
故选a;
(2)所得混合溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(OH- )═c(H+),溶液呈中性;根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{5×1{0}^{-3}×1{0}^{-7}}{0.5a-5×1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:中;$\frac{1{0}^{-9}}{a-0.01}$;
(3)CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液铵根离子和醋酸根离子水解程度相同,导致醋酸铵溶液呈中性,水电离出的氢离子浓度为1.0×10-7mol/L;水的电离程度很小,溶液中离子浓度大小顺序是c(NH4+)═c(CH3COO-)>c(OH- )═c(H+),故答案为:1.0×10-7mol/L;c(NH4+)═c(CH3COO-)>c(OH- )═c(H+);
(4)电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=$\frac{c({H}^{+}).c(HS{{O}_{3}}^{-})}{{K}_{a}}$=$\frac{0.001×0.1}{0.01}$mol/L=0.01 mol/L,故答案为:0.01 mol/L;
(5)$\root{3}{\frac{{K}_{sp}[Fe(OH)_{3}]}{0.1}}$≤c(OH- )<$\sqrt{\frac{{K}_{sp}[Mg(OH)_{2}]}{0.1}}$,$\root{3}{\frac{8.0×1{0}^{-38}}{0.1}}$mol/L≤c(OH- )<$\sqrt{\frac{1.0×1{0}^{-11}}{0.1}}$mol/L,2×10-13×$\root{3}{100}$mol/L≤c(OH- )<1×10-5mol/L,$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L<c(H+)≤$\frac{1{0}^{-14}}{2×1{0}^{-13}×\root{3}{100}}$mol/L,则3.3≤pH<9,
故答案为:3.3≤pH<9.
点评 本题考查较综合,涉及溶度积常数计算、弱电解质的电离、酸碱混合溶液定性判断等知识点,侧重考查学生分析计算能力,把握化学反应原理及难溶物溶解平衡是解本题关键,注意弱电解质电离平衡常数与其对应弱离子水解程度关系,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
下列名词中,哪个名词不属于物理量
A.长度 B.气体摩尔体积 C.摩尔 D.摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
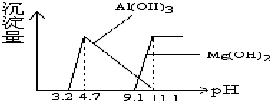 根据Al(OH)3 的Ksp=1.3×10-33、Mg(OH) 2的Ksp=5.6×10-12,等物质的量浓度AlCl3、MgCl2混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:
根据Al(OH)3 的Ksp=1.3×10-33、Mg(OH) 2的Ksp=5.6×10-12,等物质的量浓度AlCl3、MgCl2混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:| A. | Al(OH)3 和Mg(OH)2在水溶液中的电离过程完全相同 | |
| B. | 若改变溶液的pH,在pH<4.7时,n(Mg2+)几乎不变化 | |
| C. | 当pH>11.1时,溶液中只有NaCl和NaAlO2(Na[Al(OH)4]) | |
| D. | 等物质的量浓度Al3+、Mg2+混合溶液与氨水反应生成相应沉淀,氨水的pH与沉淀量关系与上图相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═H22++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Ba(OH)2═Ba2++2(OH)- | D. | Na3PO4═3Na++PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
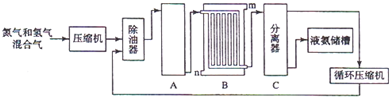
 H2+CO,CH4+H2O
H2+CO,CH4+H2O 3H2+CO;
3H2+CO;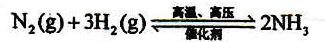 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加过程中,当溶液中c(Cu 2+)=2.2×10-2mol/L时,溶液的pH=9 | |
| B. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO4 2-) | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3•H2O)始终保持增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com