
ŅŃÖŖ³£ĪĀĻĀ£¬ÅØ¶Č¾łĪŖ0.1 mol”¤L£1µÄ4ÖÖÄĘŃĪČÜŅŗpHČēĻĀ±ķ£ŗ
| ČÜÖŹ | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
ĻĀĮŠĖµ·ØÖŠ£¬ÕżČ·µÄŹĒ (””””)
A£®ĻņĀČĖ®ÖŠ¼ÓČėNaHCO3£¬æÉŅŌŌö“óĀČĖ®ÖŠ“ĪĀČĖįµÄÅضČ
B£®ĖÄÖÖČÜŅŗÖŠ£¬Ė®µÄµēĄė³Ģ¶Č×ī“óµÄŹĒNaClO
C£®³£ĪĀĻĀ£¬ĻąĶ¬ĪļÖŹµÄĮæÅØ¶ČµÄH2SO3”¢H2CO3”¢HClO£¬pH×ī“óµÄŹĒH2SO3
D£®NaHSO3ČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”Ė³ŠņĪŖc(Na£«)>c(H£«)>c(HSO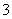 )>c(SO
)>c(SO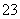 )>c(OH£)
)>c(OH£)
 ĆĻ½ØĘ½“ķĢā±¾ĻµĮŠ“š°ø
ĆĻ½ØĘ½“ķĢā±¾ĻµĮŠ“š°ø ³¬ÄÜѧµäÓ¦ÓĆĢāĢāæØĻµĮŠ“š°ø
³¬ÄÜѧµäÓ¦ÓĆĢāĢāæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
»ÆѧÓėÉē»į”¢Éś²ś”¢Éś»īĆÜĒŠĻą¹Ų£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®ŅŅ“¼ŗĶĘūÓĶ¶¼ŹĒæÉŌŁÉśÄÜŌ“£¬Ó¦“óĮ¦ĶĘ¹ćŹ¹ÓĆŅŅ“¼ĘūÓĶ
B£®¶žŃõ»ÆĀČ¾ßÓŠ»¹ŌŠŌ£¬æÉÓĆÓŚ×ŌĄ“Ė®µÄɱ¾śĻū¶¾
C£®ÉńÖŪ·É“¬ĖłÓĆĢ«ŃōÄܵē³Ų°åæɽ«¹āÄÜ×Ŗ»»ĪŖµēÄÜ£¬ĖłÓĆ×Ŗ»»²ÄĮĻŹĒµ„¾§¹č
D£®”°ĮÉÄž½¢”±ÉĻÓĆÓŚ½¢ŌŲ»ś½µĀäĄ¹×čĖ÷µÄŹĒŅ»ÖÖĢŲÖÖøÖĄĀ£¬ŹōÓŚŠĀŠĶĪŽ»ś·Ē½šŹō²ÄĮĻ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÓĆNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®50mL 18.4mol”¤L-1ÅØĮņĖįÓė×ćĮæĶĪ¢ČČ·“Ó¦£¬Éś³ÉSO2·Ö×ÓŹżÄæĪŖ0.46NA
B£®³£ĪĀ³£Ń¹ĻĀ£¬4.6gNO2ÓėN2O4»ģŗĻĘųÖŠŗ¬ÓŠ0.3NAøöŌ×Ó
C£®1L0.1mol”¤L-1Na2CO3ČÜŅŗÖŠŗ¬ÓŠµÄŅõĄė×ÓŹżĪŖ0.1NA
D£®±ź×¼×“æöĻĀ£¬22.4LCCl4ÖŠŗ¬ÓŠNAøö·Ö×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½«51.2 g CuĶźČ«ČÜÓŚŹŹĮæÅØĻõĖįÖŠ£¬ŹÕ¼Æµ½µŖµÄŃõ»ÆĪļ(ŗ¬NO”¢N2O4”¢NO2)µÄ»ģŗĻĪļ¹²0.9 mol£¬ÕāŠ©ĘųĢåĒ”ŗĆÄܱ»500 mL 2 mol”¤L-1 NaOHČÜŅŗĶźČ«ĪüŹÕ£¬Éś³Éŗ¬NaNO3ŗĶNaNO2µÄŃĪČÜŅŗ”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A£®ĻūŗÄĻõĖįµÄĪļÖŹµÄĮæĪŖ2.5mol
B£®ĘųĢåÖŠN2O4µÄĪļÖŹµÄĮæĪŖ0.1mol
C£®Éś³ÉNaNO3µÄĪļÖŹµÄĮæĪŖ0.2 mol
D£®Éś³ÉµÄµŖµÄŃõ»ÆĪļµÄ»ģŗĻĘųµ¹ÖĆÓŚĖ®²ŪÖŠ£¬ĶØČė±ź×¼×“æöĻĀ8.96L O2Ź±£¬ĘųĢåĶźČ«±»ĪüŹÕ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŹŅĪĀŹ±½«ÅضČŗĶĢå»ż·Ö±šĪŖc1”¢V1µÄNaOHČÜŅŗŗĶc2”¢V2µÄCH3COOHČÜŅŗĻą»ģŗĻ£¬ĻĀĮŠ¹ŲÓŚøĆ»ģŗĻČÜŅŗµÄŠšŹö“ķĪóµÄŹĒ (””””)
A£®ČōpH>7£¬ŌņŅ»¶ØŹĒc1V1£½c2V2
B£®ŌŚČĪŗĪĒéæöĻĀ¶¼ŹĒc(Na£«)£«c(H£«)£½c(CH3COO£)£«c(OH£)
C£®µ±pH£½7Ź±£¬ČōV1£½V2£¬ŌņŅ»¶ØŹĒc1£¼c2
D£®ČōV1£½V2”¢c1£½c2£¬Ōņc(CH3COO£)£«c(CH3COOH)£½c(Na£«)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½ńÓŠ¢ŁCH3COOH£»¢ŚHCl£»¢ŪH2SO4ČżÖÖČÜŅŗ£¬Ń”ŌńĢīæÕ£ŗ
A£®¢Ł£¾¢Ś£¾¢Ū B£®¢Ł£¼¢Ś£¼¢Ū C£®¢Ł=¢Ś=¢Ū D£®¢Ł=¢Ū£¾¢Ś
E£®¢Ł£¾¢Ś=¢Ū F£®¢Ł£¼¢Ś=¢Ū G£®¢Ł=¢Ś£¼¢Ū H£®¢Ł=¢Ś£¾¢Ū
(1)µ±ĖüĆĒpHĻąĶ¬Ź±£¬ĘäĪļÖŹµÄĮæÅØ¶Č¹ŲĻµŹĒ ”£
(2)Ģå»żŗĶĪļÖŹµÄĮæÅضČĻąĶ¬µÄ¢Ł”¢¢Ś”¢¢ŪČżČÜŅŗ£¬·Ö±šÓėĶ¬ÅØ¶ČµÄÉÕ¼īČÜŅŗ·“Ó¦£¬ŅŖŹ¹·“Ó¦ŗóµÄČÜŅŗ³ŹÖŠŠŌ£¬ĖłŠčÉÕ¼īČÜŅŗµÄĢå»ż¹ŲĻµĪŖ ”£
(3)µ±ĖüĆĒpHĻąĶ¬”¢Ģå»żĻąĶ¬Ź±£¬·Ö±š¼ÓČė×ćĮæŠæ£¬ĻąĶ¬×“æöĻĀ²śÉśĘųĢåĢå»ż¹ŲĻµĪŖ ”£
(4)½«pHĻąĶ¬µÄČżÖÖĖį¾łĻ”ŹĶ10±¶ŗó£¬pH¹ŲĻµĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬ŅŃÖŖĻĀĮŠø÷·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĻĀĮŠø÷ČČ»Æѧ·½³ĢŹ½ÖŠ¦¤H×īŠ”µÄŹĒ
A£®2A(l)£«B(l)===2C(g)””¦¤H1 B£® 2A(g)£«B(g)===2C(l)”” ¦¤H2
C£®2A(g)£«B(g)===2C(g)””¦¤H3 D£®2A(l)£«B(l)===2C(l)””¦¤H4
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
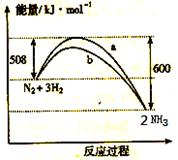
ÓŅĶ¼ŹĒ198K Ź±N2ÓėH2·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆµÄĒśĻßĶ¼”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
A£®øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ
N2 + 3H2  2NH3, ”÷H = -92kJ”¤mol-1
2NH3, ”÷H = -92kJ”¤mol-1
B£®aĒśĻߏĒ¼ÓČė“߻ƼĮŹ±µÄÄÜĮæ±ä»ÆĒśĻß
C£®¼ÓČė“߻ƼĮ, øĆ»Æѧ·“Ó¦µÄ·“Ó¦ČČøıä
D£®ŌŚĪĀ¶Č”¢Ģå»żŅ»¶ØµÄĢõ¼žĻĀ, ĶØČėlmol N2ŗĶ3molH2 ·“Ó¦ŗó·Å³öµÄ ČČĮæĪŖQ1kJ, ČōĶØČė2mol N2ŗĶ6mol H2 ·“Ó¦ŗó·Å³öµÄČČĮæĪŖQ2kJ Ōņ184>Q2 >2Q1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijŠ£»ÆѧŠĖȤŠ”×éŌŚŹµŃéŹŅÖŠ·¢ĻÖŅ»ĘæČÜŅŗ£¬±źĒ©ÉĻ±źÓŠ”°CaCl2,0.1 mol”¤L£1”±µÄ×ÖŃł£¬ĻĀĆęŹĒøĆŠ”×é³ÉŌ±¶ŌøĆČÜŅŗµÄŠšŹö£¬ÕżČ·µÄŹĒ(””””)
A£®ÅäÖĘ1 LøĆČÜŅŗ£¬æɽ«0.1 mol CaCl2ČÜÓŚ1 LĖ®ÖŠ
B£®Ca2£«ŗĶCl£µÄĪļÖŹµÄĮæÅØ¶Č¶¼ŹĒ0.1 mol”¤L£1
C£®“ÓŹŌ¼ĮĘæÖŠČ”øĆČÜŅŗµÄŅ»°ė£¬ŌņĖłµĆČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ0.05 mol”¤L£1
D£®½«øĆĘæČÜŅŗĻ”ŹĶŅ»±¶£¬ŌņĖłµĆČÜŅŗµÄc(Cl£)ĪŖ0.1 mol”¤L£1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com