
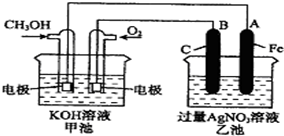
 如图是一个化学过程的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O则下列说法中不正确的是( )
如图是一个化学过程的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O则下列说法中不正确的是( )| A. | 甲池是燃料电池,其中通入氧气的一极是原电池的正极 | |
| B. | 乙池是电解池,铁电极是阴极,一段时间后会析出金属银 | |
| C. | 甲池是电解池,乙是原电池 | |
| D. | 甲池一段时间后溶液的pH值会变小 |
分析 根据反应方程式知,甲装置是燃料电池,通入甲醇的一极为负极,通入氧气的一极为正极;乙有外加电源,所以是电解池,石墨与原电池的正极相连,所以B石墨电极是阳极,Fe为阴极,阴极上银离子得电子生成Ag,结合反应方程式判断溶液的pH.
解答 解:A.甲装置是燃料电池,通入甲醇的一极为负极,通入氧气的一极为正极,故A正确;
B.Fe与原电池的负极相连,Fe为阴极,阴极上银离子得电子生成Ag,故B正确;
C.甲装置是燃料电池,乙有外加电源,是电解池,故C错误;
D.甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,反应消耗KOH,溶液的碱性减小,则pH减小,故D正确.
故选C.
点评 本题考查了原电池原理和电解池原理的应用,明确电极判断方法、电极反应的书写等是解题关键,侧重于考查学生的分析能力,题目难度不大.


科目:高中化学 来源: 题型:解答题
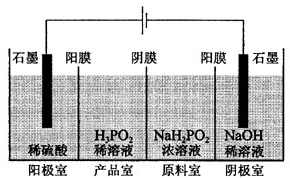 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时体积V(A)=V(B)=a L,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
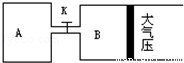
(1)B中X的转化率α(X)B为_________。
(2)A中W和B中Z的物质的量的比较:n(W)A __________________ n(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为_________升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容 器恢复原来反应前的体积,可采取的措施是____________________。
器恢复原来反应前的体积,可采取的措施是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||
| B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
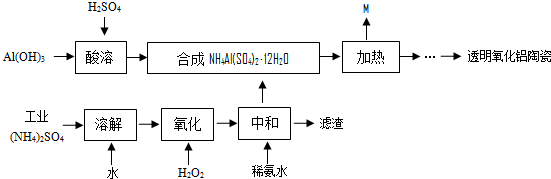
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | HClO | HNO3 |
| 弱电解质 | HF | BaSO4 | CaCO3 | CH3COOH |
| 非电解质 | Cl2 | CS2 | C2H5OH | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
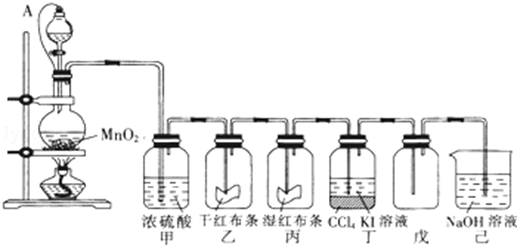
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Na-K合金<Na<氯化钠 | |
| B. | 非金属氢化物的稳定性顺序:H2O>H2S>H2Se,HCl<H2S<PH3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 | |
| D. | 同一原子中,2p、3p、4p能级的轨道数依次增多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com