

| A. | 反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 | |
| B. | 在铜的电解精炼过程中,若转移1mol电子,则阳极溶解32gCu | |
| C. | 常温下向CuS的悬浊液中加入饱和MnSO4溶液可生成MnS沉淀,则Ksp(MnS))<Ksp(CuS) | |
| D. | 常温下用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线(如图)表示的是滴定盐酸的曲线 |
分析 A、反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)为上熵减的反应,在室温下可自发进行,则该反应的△H<0;
B、在铜的电解精炼过程中,若转移1mol电子,则阳极溶解的不仅仅是铜,还有铁锌等金属,故铜的质量小于32gCu;
C、加入饱和MnSO4溶液,如满足Qc>Ksp,则生成沉淀;
D、相同物质的量浓度和相同体积的盐酸和醋酸,醋酸是弱电解质,盐酸溶液pH小于醋酸.
解答 解:A、反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)为上熵减的反应,在室温下可自发进行,则该反应的△H<0,故A正确;
B、在铜的电解精炼过程中,若转移1mol电子,则阳极溶解的不仅仅是铜,还有铁锌等金属,故铜的质量小于32gCu,故B错误;
C、加入饱和MnSO4溶液,如满足Qc>Ksp,则生成沉淀,不能比较溶度积大小,故C错误;
D、相同物质的量浓度和相同体积的盐酸和醋酸,醋酸是弱电解质,盐酸溶液pH小于醋酸,图象中虚线是盐酸,故D错误;
故选A.
点评 本题考查了反应自发进行的分析判断方法、电解原理、沉淀的转化、滴定曲线,理解概念是解题关键,题目难度中等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:多选题
| A. | S2Cl2做氧化剂,H2O做还原剂 | |
| B. | 每生成l mol SO2转移4 mol电子 | |
| C. | 氧化产物与还原产物的物质的量之比为l:3 | |
| D. | 每生成48g硫会断裂2mol氢氧键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2CH3)2的系统命名为3-甲基戊烷,与CH3CH2CH(CH3)CH2CH3互为同系物 | |
| B. | 乙烯、氯乙烯和聚氯乙烯都能因发生加成反应而使溴水褪色 | |
| C. | 用甘氨酸(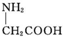 )和丙氨酸( )和丙氨酸( )的混合物在一定条件下可形成四种链状二肽 )的混合物在一定条件下可形成四种链状二肽 | |
| D. | 甲苯(C7H8)和甘油(C3H8O3)混合物,当总质量一定时,随$\frac{n({C}_{7}{H}_{8})}{n({C}_{3}{H}_{8}{O}_{3})}$比值增大,耗氧量和生成水的量都增大. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
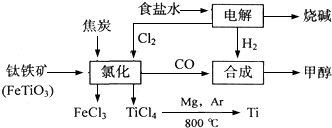
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞呈红色的溶液:Na+、NO3-、Ba2+、Br- | |
| B. | 加水稀释pH减小的溶液:K+、Al3+、Cl-、CH3COO- | |
| C. | 含有大量Fe(NO3)2的溶液:NH4+、H+、SO42-、I- | |
| D. | c(OH-)<$\sqrt{{K}_{w}}$的溶液:ClO-、NO3-、Na+、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24.
原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 22.4g | C. | 5.6g | D. | 56g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
 (3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.
(3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.
一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com