
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
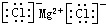 ;
;分析 (1)短周期元素中,C、E都有-2价,处于ⅥA族,C有+6价且原子半径C>E,故C为硫、E为氧;D有+7、-1价,原子半径大于氧,故D为Cl;A、B化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径A>B>硫,故A为Mg、B为Al;
(2)B为Al元素,结合周期表分析;
(3)元素的非金属性越强,其最高价氧化物的水化物的酸性越强;
(4)A、D形成的化合物为氯化镁,是离子化合物;
(5)C为S,E为O,二者形成共价化合物.
解答 解:(1)短周期元素中,C、E都有-2价,处于ⅥA族,C有+6价且原子半径C>E,故C为硫、E为氧;D有+7、-1价,原子半径大于氧,故D为Cl;A、B化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径A>B>硫,故A为Mg、B为Al;它们在周期表中位置为:
| O | |||||||||||||||||
| Mg | Al | S | Cl | ||||||||||||||
| O | |||||||||||||||||
| Mg | Al | S | Cl | ||||||||||||||
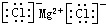 ;
;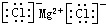 ;
;点评 本题考查结构性质位置关系综合应用,根据原子半径与化合价推断元素是解题关键,注意对元素周期律的理解掌握,侧重于考查学生的分析能力和对基础知识的应用能力.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:解答题
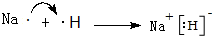 .
.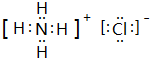 ,A2C2的电子式为
,A2C2的电子式为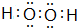 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中,只存在离子键,不可能存在其他化学键 | |
| B. | 原子晶体中,只存在共价键;稀有气体的原子能形成分子晶体 | |
| C. | NaHSO4、NaOH晶体中的阴、阳离子个数比均为1:2 | |
| D. | 晶体熔点:金刚石>食盐>干冰>冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Al能放出H2的溶液中:NH4+,SO42-,Br-,NO3- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | 无色强酸性溶液中:Na+、Cl-、SO42-、Cu2+ | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机化合物分子中的基团之间存在着相互影响.
有机化合物分子中的基团之间存在着相互影响.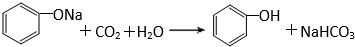 .
.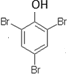 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
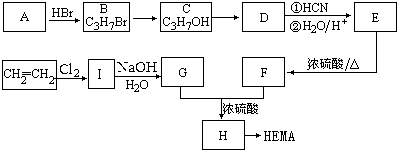
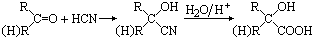
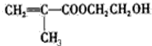 甲基丙烯酸羟乙酯
甲基丙烯酸羟乙酯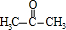 +2H2O.
+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
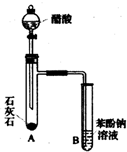
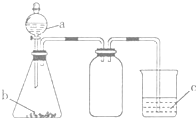 利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )| 试剂a | 试剂b | 试剂c | 实验目的 | |
| ① | 盐溶液X | NaOH | 酚酞 | 证明X中含有NH4+ |
| ② | 浓盐酸 | CaCO3 | Na2SiO3溶液 | 证明酸性: HCl>H2CO3>H2SiO3 |
| ③ | 浓盐酸 | MnO2 | 淀粉KI溶液 | 证明氧化性: MnO2>C12>I2 |
| ④ | 浓硫酸 | C | 澄清石灰水 | 证明产物中含有CO2 |
| A. | ①②③ | B. | ①③ | C. | ②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子的最外层电子数依次增多 | |
| B. | Si、P、S元素的最高正价依次升高 | |
| C. | C、N、O的原子半径依次增大 | |
| D. | Li、Na、K的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 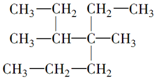 4-甲基-4,5-二乙基乙烷 4-甲基-4,5-二乙基乙烷 | B. |  3,3-二甲基-1-戊炔 3,3-二甲基-1-戊炔 | ||
| C. | 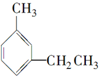 3-甲基乙基苯 3-甲基乙基苯 | D. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com