
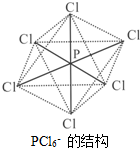
 氮、磷属于同主族元素,广泛存在于生产生活的各种物质中.
氮、磷属于同主族元素,广泛存在于生产生活的各种物质中. ,故答案为:
,故答案为: ;
;| 5-3×1 |
| 2 |


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
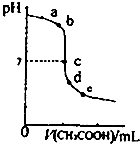 25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )
25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )| A、水电离出的氢离子浓度:a>b |
| B、c点时恰好中和 |
| C、在d~e之间存在如下关系C(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、e点时溶液中溶质是CH3COONa和CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| B、由水电离的c(H+)为10-3mol?L-1的溶液中,Na+、NO3-、SO32-、Cl-定能大量共存 |
| C、酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,导致计算结果偏低 |
| D、可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
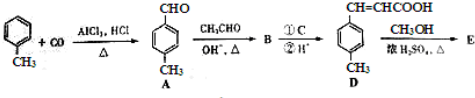
| OH-,△ |
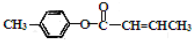 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | A的最高价氧化物对应的水化物化学式为H2AO3 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
| D | D的基态原子最外层电子排布式为3s23p2 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
 |
 |
 |
 |
| 成分为二氧化硅 | 要检测其中的碘元素 | 铁管与铜管二者相连 | 用自来水养金鱼时需要先“晒水” |
| 一种常见的硅酸盐材料 | 先将其还原为单质,再加淀粉 | 铁管不易腐蚀 | 目的是使水温升高 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、布朗运动就是液体分子的热运动 |
| B、对一定质量的气体加热,其内能一定增加 |
| C、物体的温度越高,分子热运动越剧烈,分子的平均动能越大 |
| D、分子间的引力与斥力同时存在,斥力总是小于引力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com