
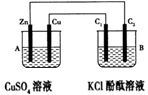
 2KOH+H2↑+Cl2↑,即装置中有氢氧化钾强碱生成,因此溶液的碱性增强。
2KOH+H2↑+Cl2↑,即装置中有氢氧化钾强碱生成,因此溶液的碱性增强。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| 实验1 | 将金属X与金属Y用导线连接,浸入电解质溶液中,Y不易被腐蚀 |
| 实验2 | 将片状的金属X、W分别投入等体积、等物质的量浓度的盐酸中,都有气体产生,W比X反应剧烈 |
| 实验3 | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁棒附近产生OH- | B.铁棒质量减少 |
| C.石墨棒上放出氢气 | D.石墨棒上放出氧气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
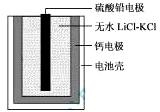
| A.正极反应式:Ca + 2Cl--2e- = CaCl2 |
| B.放电过程中,Li+向负极移动 |
| C.每转移0.1mol电子,理论上生成20.7 g Pb |
| D.常温时,在正负极间接上电流表或检流计,指针不偏转 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
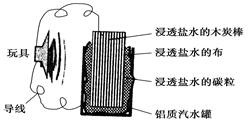
| A.铝罐将逐渐被腐蚀 |
| B.碳粒和炭棒上发生的反应为:O2+4e-=2O2- |
| C.炭棒应与玩具电机的负极相连 |
| D.该电池工作一段时间后炭棒和碳粒的质量会减轻 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
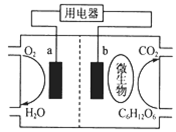
| A.该电池能够在高温下工作 | B.b电极发生还原反应 |
| C.O2在a电极被氧化 | D.电流从a电极经用电器流向b电极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼铜时粗铜作阳极 |
| C.在镀件上镀铜时可用铜作阳极 |
| D.电解稀H2SO4制H2、O2时铜做阳极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3molPb | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
| D | 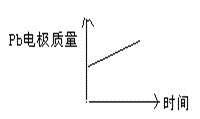 | 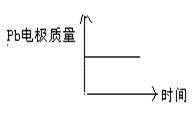 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.装置A是原电池,装置B是电解池 |
| B.反应一段时间后,装置B中溶液pH增大 |
| C.a口若消耗1 mol CH4,d口可产生4 mol气体 |
D.a口通入C2H6时的电极反应为C2H6-14e-+18OH- 2 2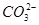 +12H2O +12H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com