
| A、氯气通入碘化钾溶液中 |
| B、碘水加入溴化钠溶液中 |
| C、溴水加入氯化钠溶液中 |
| D、碘水加入氯化钠溶液中 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 具有相同官能团的同分异构体的结构简式为
具有相同官能团的同分异构体的结构简式为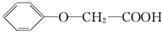 )有多种酯类的同分异构体.其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是
)有多种酯类的同分异构体.其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| Y | ||
| Z |
| A、C Al Ca |
| B、He F S |
| C、Al Ca Rb |
| D、O P Ge |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、负极发生的反应为:Fe-2e-=Fe2+ |
| B、正极发生的反应为:4OH--4e-═2H2O+O2↑ |
| C、原电池是将电能转变为化学能的装置 |
| D、钢柱在水下部分比在空气与水交界处更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.1 mol?L-1的CH3COONa溶液中CH3COO- 的总数是0.1NA |
| B、常温常压下,1.6g O2 和O3 混合气体中质子总数为0.8 NA |
| C、一定条件下,2mol SO2 和 1mol O2 发生反应,转移的电子总数一定是2NA |
| D、1L 0.1mol?L-1的葡萄糖溶液中分子总数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、欲配制1.00 L 1.00 mol?L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
| B、1 mol Cl2与足量的铁反应,转移的电子数为3NA |
| C、0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10 NA |
| D、标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某一容积可变的密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)△H<0,回答下列问题:
某一容积可变的密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)△H<0,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com