
【题目】某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述正确的是( )
A.H2Y的电离方程式为:![]()
B.在该酸式盐溶液中![]()
C.HY-的水解方程式为![]()
D.在该酸式盐溶液中![]()
【答案】A
【解析】
A.H2Y是二元弱酸,电离时分两步电离,第一步电离生成氢离子和酸式酸根离子,电离方程式为:![]() ,A项正确;
,A项正确;
B.NaHY的水溶液中,阴离子水解,钠离子不水解,所以c(Na+)>c(HY);HY的电离程度小于HY的水解程度,但无论电离还是水解都较弱,阴离子还是以HY为主,溶液呈碱性,说明溶液中c(OH)>c(H+);因溶液中还存在水的电离,则c(H+)>c(Y2),所以离子浓度大小顺序为:c(Na+)>c(HY)>c(OH)>c(H+)>c(Y2),B项错误;
C.HY水解生成二元弱酸和氢氧根离子,水解方程式为:HY+H2OOH+H2Y,选项中是电离方程式,C项错误;
D. 根据电荷守恒式可知,在该酸式盐溶液中![]() ,D项错误;
,D项错误;
答案选A。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 键角:BF3>CH4>H2O>NH3
B. CO2、HClO、HCHO分子中一定既有σ键又有π 键
C. 已知二茂铁(Fe(C5H5)2)熔点是173 ℃(在100 ℃时开始升华),沸点是249℃,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,C5H5 -与Fe2+之间是以离子键相结合
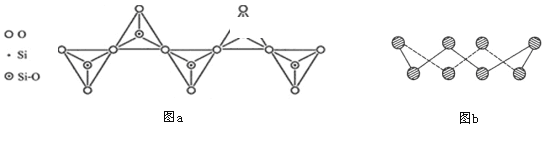
D. 在硅酸盐中,SiO44-四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从植物中提取的天然化合物a-damascone,可用于制作“香水”,其结构为: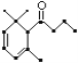 ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
A. 分子式为C13H20O
B. 1mo该化合物可与3molH2发生加成反应
C. 1mol该化合物完全燃烧消耗18 mol O2
D. 1mol该化合物最多与2mol溴单质加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
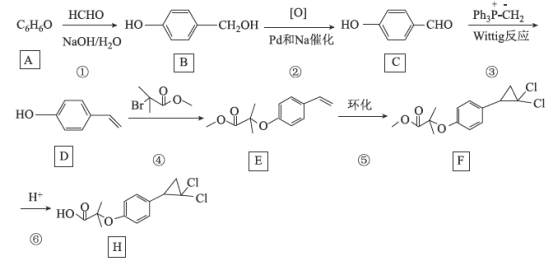
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
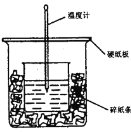
【题目】用50mL 0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH 溶液反应测定中和热。下图装置不妥之处是_______,应如何改正____________,NaOH的量要比HCl多一些的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应a A(g)+b B(s)![]() c C(g)+d D(g)达平衡后,保持温度不变,将容器缩小为原来的一半,达到新的平衡时,A的浓度是原来的1.6倍,则下列说法正确的是
c C(g)+d D(g)达平衡后,保持温度不变,将容器缩小为原来的一半,达到新的平衡时,A的浓度是原来的1.6倍,则下列说法正确的是
A. 平衡向逆反应方向移动B. a<c+d
C. 物质A的转化率增大D. 物质D的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要的化工原料,工业上利用N2和H2合成NH3,方程式如下:![]()
![]()
![]()
(1)已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是_____。
A. 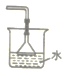 B.
B. 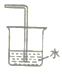 C.
C. 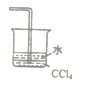 D.
D. 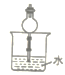
(2)某温度下,在一体积恒定为10L的密闭容器内模拟合成氨反应。写出该反应的平衡常数表达式_______。若要增大反应速率,且平衡向正反应方向移动,下列措施中可行的是_____(填字母代号)。
A. 压缩容器体积 B. 适当升高温度 C. 通入适量氮气 D. 加适量催化剂
(3)能说明上述反应达到平衡状态的是____________
A. ![]() B. 混合气体的密度不再改变
B. 混合气体的密度不再改变
C. 混合气体的平均相对分子质量不再改变 D. 单位时间内生成n mol N2 的同时生成2n mol NH3
(4)氨气溶于水所得溶液在加水稀释的过程中(本小题填“增大”或“减小”或“不变”),
![]() 的电离程度______,溶液的pH值_____。
的电离程度______,溶液的pH值_____。
氨气与酸反应得到铵盐,某![]() 水溶液的pH=5,原因是溶液中存在平衡_____(用离子方程式表示),该稀溶液中水的电离度约为________。
水溶液的pH=5,原因是溶液中存在平衡_____(用离子方程式表示),该稀溶液中水的电离度约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)①将合成气以n(H2)∶n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__(填字母)。
CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__(填字母)。
A. ΔH<0
B. p1<p2<p3
C. 若在p3和316 ℃时,起始时n(H2)∶n(CO)=3,则达到平衡时,CO转化率小于50%
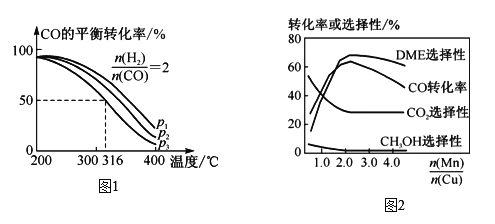
②采用一种新型的催化剂(主要成分是Cu-Mn合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题:催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(2)CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______。

(3)在一定条件下,可发生反应6H2(g)+2CO2(g)![]() CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
500K | 600K | 700K | 800K | |
n(H2)∶n(CO2)=1.5 | 45 | 33 | 20 | 12 |
n(H2)∶n(CO2)=2 | 60 | 43 | 28 | 15 |
n(H2)∶n(CO2)=3 | 83 | 62 | 37 | 22 |
根据上表中数据
①温度一定时,提高氢碳比n(H2)∶n(CO2)],CO2的转化率__(填“增大”、“减小”或“不变”)。
②该反应的正反应为___热反应(填“吸”或“放”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
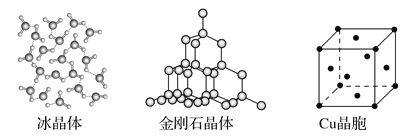
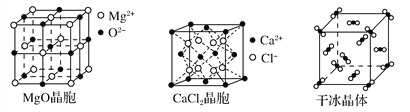
【题目】下图为几种晶体或晶胞的示意图:
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为________________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能______(填“大于”或“小于”)MgO晶体,原因是________________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com