
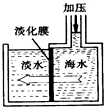
 我国有较长的海岸线,浩渺的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.
我国有较长的海岸线,浩渺的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.分析 Ⅰ.水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能透过淡化膜从而得到淡水;
Ⅱ.从海水中提取食盐,采用的方法是海水晒盐;
(1)除去不溶性杂质需要用过滤装置,依据过滤装置选择玻璃仪器;
(2)检验硫酸根离子,可先加入盐酸,如无现象,再加入氯化钡检验;
(3)从电离的角度分析粗盐中的杂质可知:溶液中的杂质离子为钙离子、镁离子、和硫酸根离子,根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后可以将过量的钡离子沉淀;
(4)最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子;
Ⅲ.海水中含有MgCl2,工业上从海水中提取镁,在海水苦卤中加石灰乳过滤得沉淀氢氧化镁,然后加盐酸得到氯化镁,经浓缩、结晶、脱水、电解可以得到金属镁;
Ⅳ.(1)氯气有强氧化性,能氧化溴离子生成溴单质,还原剂失电子化合价升高而发生氧化反应;
(2)溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应;
(3)用于萃取实验的仪器是分液漏斗,萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在水中的溶解度,萃取剂和原溶剂不互溶,萃取剂和溶质不反应.
解答 解:Ⅰ.海水中溶剂是水,由水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能透过淡化膜说明加压后右侧海水中溶剂减少,溶质不变,所以溶液质量也减少,由于溶质不变,所以溶质质量分数增大.
故答案为:B;
Ⅱ.从海水中提取食盐,采用的方法是海水晒盐,
故答案为:海水晒盐;
(1)除去不溶性杂质可以利用过滤装置分离,用到的玻璃仪器是烧杯、玻璃棒、漏斗,故答案为:烧杯、漏斗、玻璃棒;
(2)检验硫酸根离子,可先加稀盐酸,再加BaCl2溶液,如生成沉淀,说明含有硫酸根离子,故答案为:先加稀盐酸,再加BaCl2溶液;
(3)首先要把粗盐溶于水形成溶液,然后镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,Ca2++CO32-=CaCO3↓,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,Ba2++CO32-=BaCO3↓,离子都沉淀了,再进行过滤,为使离子沉淀完全,需要加入的试剂都必须是过量;
故答案为:BaCl2;Na2CO3;稍过量;
(4)最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后经蒸发操作得到较纯净的氯化钠,故答案为:稀盐酸;
Ⅲ.A.在海水苦卤中加氢氧化钠过滤得沉淀氢氧化镁,Mg(OH)2热稳定性差,受热分解,工业上,电解熔融MgCl2冶炼金属镁,故A错误;
B.海水中含有可溶性的Mg2+、Ca2+、Fe3+、SO42-、Na+、Cl-、加盐酸得不到纯净的氯化镁溶液,所以无法得到纯净的氯化镁固体,故B错误;
C.在海水苦卤中加氢氧化钠过滤得沉淀氢氧化镁,灼烧得到氧化镁,但MgO的熔点为2800℃、熔点高,电解时耗能高,所以,工业上,电解熔融MgCl2冶炼金属镁,故C错误;
D.在海水苦卤中加氢氧化钠过滤得沉淀氢氧化镁,再将沉淀分离后加入盐酸变成MgCl2,之后经过滤、干燥、电解,即可得到金属镁,故D正确;
故选D;
Ⅳ.(1)氯气有强氧化性,能氧化溴离子生成溴单质,自身被还原生成氯离子,离子反应方程式为:Cl2+2Br-=Br2+2Cl-;Br2+3CO32-=BrO3-+5Br-+3CO2↑中Br2的化合价由0价变为+5价和-1价,所以Br2是氧化剂发生还原反应,也是还原剂发生氧化反应,还原剂、氧化剂都为Br2;
故答案为:Cl2+2Br-=Br2+2Cl-;Br2;Br2;
(2)溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应生成硫酸和氢溴酸,反应方程式为:Br2+SO2+2H2O=2HBr+H2SO4;
故答案为:Br2+SO2+2H2O=2HBr+H2SO4;
(3)用于萃取实验的仪器是分液漏斗,萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在水中的溶解度,萃取剂和原溶剂不互溶,萃取剂和溶质不反应,根据萃取剂的选取标准知,乙醇、硝酸都和水互溶,所以不能作萃取剂,能作萃取剂的是苯、四氯化碳;
故答案为:分液漏斗;②④.
点评 本题以海水资源的综合利用为载体综合考查物质的分离、提纯,侧重于学生的分析、实验能力的考查,题目难度中等,涉及萃取剂的选取、氧化还原反应、等知识点,从整体上分析流程,明确每一步可能发生的反应及基本操作,再结合基本概念、基本理论是解答关键.


科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | Wg该原子的物质的量一定是$\frac{W}{a{N}_{A}}$mol | |
| C. | Wg该原子中含有$\frac{W}{a}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{12}{b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 微粒浓度关系:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
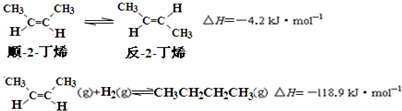
| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: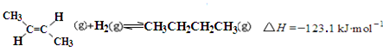 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
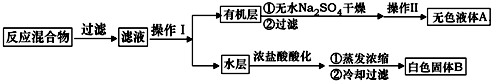
 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
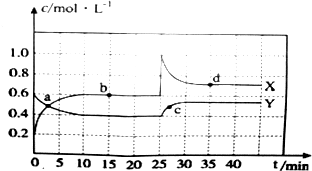
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+H2O═Na++H2 | |
| B. | 氯化铵溶液显酸性的原因:NH4++H2O═NH3•H2O+H+ | |
| C. | AICl3溶液中加入足量氨水:Al3++4NH3•H2O═AlO2-+4NH4+2H2O | |
| D. | 氯化铁溶液中滴加少量的硫化氢溶液:2Fe3++H2S═2Fe2++S+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解; | 溶液呈黄绿色,说明溶液中可能含Fe2+和Fe3+. |
| 步骤2:取少量溶液,滴 加0.01mol/L的KMnO4溶液. | 若紫红色不褪去,则说明催化剂中含铁元素的价态+3价;若紫红色褪去, 则说明催化剂中含有铁元素的价态为+2价 |
| 步骤3:另取少量溶液,滴 加20%的KSCN溶液. | 若溶液变为血红色,则说明催化剂中含铁元素的价态+3价;若溶液无变化,则说明催化剂中含铁元素的价态+2价; |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com