
下列各环境下的离子组合一定能大量共存的是( )
A.c(HCO3-)=1×10-1mol/L的溶液中Na+、AlO2-、CH3COO-、K+
B.由水电离出的c(H+)=1×10-14mol/L的溶液中CO32-、NH4+、SO42-、K+
C.甲基橙呈红色的溶液中Fe2+、Cl-、NO3-、Na+
D.能使pH试纸呈红色的溶液中Mg2+、Cl-、NO3-、SO42-
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是( )
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的平均摩尔质量不变 D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色
的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚。其结
构简式如下图。有关瘦肉精的说法不正确 ( )
 A.化学式为C12H18ON2C12
A.化学式为C12H18ON2C12
B.遇FeCl3溶液发生显色反应
C.属于芳香族化合物
D.可以发生取代、加成、酯化、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.下图是某煤化工产业链的一部分,试运用所学知识,解决下列问题:
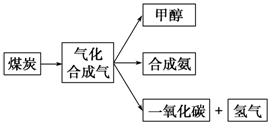
(1)已知该产业链中某反应的平衡常数表达式为
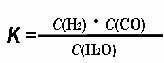 ,它所对应反应的化学方程式是 。
,它所对应反应的化学方程式是 。
(2)合成甲醇的主要反应是2H2(g)+CO(g)  CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如下:
CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol·L-1) | 0.2 | 0.1 | 0.4 |
①该时间段内反应速率v(H2)=________。
②比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡______(填“逆向”、“正向”或“不”)移动,平衡常数K____________(填“增大”、“减小”或“不变”)。
(3)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2(g)+O2(g)===2NO(g) ΔH=+180.8 kJ·mol-1,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是________________________________
(填字母序号)。
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2 000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮和工业固氮都能非常容易进行
B.常温下,大气固氮与工业固氮完成程度相差不大
C.工业固氮时温度越低,氮气与氧气反应越完全
D.K越大说明合成氨反应的速率越大
Ⅱ. 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-。
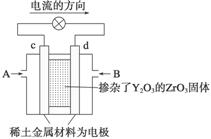
(1)c电极的名称为________。
(2)d电极上的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
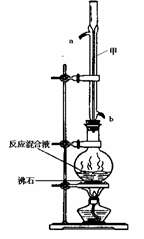 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如右图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯。有关物质的物理性质见下表所示:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如右图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯。有关物质的物理性质见下表所示:
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol 甲醇,再小心加入 3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)甲装置的作用是: ;冷却水从 (填“a”或“b”)口进入。
(2)化学小组在实验中用过量的反应物甲醇,其理由是 。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制

(1)试剂1可以是 (填编号),作用是 。
A.稀硫酸 B.碳酸钠溶液 C. 乙醇
(2)操作2中,收集产品时,控制的温度应在 ℃左右。
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为 (结果保留三位有效数字)。
(4)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是 (填编号)。
A.蒸馏时从100℃开始收集产品 B.甲醇用量多了 C.制备粗品时苯甲酸被蒸出
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为制取乙酸乙酯的实验装置图。回答下列问题:

揭示实验原理
①乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯。请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式______________________。
②能否用氢同位素示踪法揭示酯化反应原理? _______(选填“能”或“不能”),原因是___________________。
反应温度确定:
合成乙酸乙酯的反应为放热反应。实验表明,反应温度应控制在85℃左右为宜。回答:
实验温度不宜低于85℃左右的原因是__________________________________________;
实验温度不宜高于85℃左右的原因是__________________________________________;
实验装置的比较:
利用右图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是___________。
酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴____试液,现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1下列说法或表示方法正确的是( )
A.乙烯的结构简式CH2CH2
B. 化学名词:乙酸乙脂、笨、油酯、坩锅

C、右边是一种烃的结构简式
 D.聚乙烯的化学式为
D.聚乙烯的化学式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com