
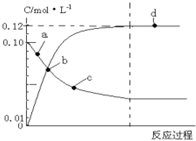
 373K时,N2O4(g)?2NO2(g)平衡体系的建立过程中各物质浓度与时间的关系如图,下列说法正确的是( )
373K时,N2O4(g)?2NO2(g)平衡体系的建立过程中各物质浓度与时间的关系如图,下列说法正确的是( )| A. | 反应达到a点时,正反应速率大于逆反应速率 | |
| B. | 反应达到b时,表示反应达到平衡 | |
| C. | 反应达到b点时,NO2和 N2O4二者浓度相等 | |
| D. | 反应达到d点时,N2O4的转化率为40% |
分析 A.图象分析可知达到平衡状态前,a点是四氧化二氮浓度减小,二氧化氮浓度增大,反应正向进行;
B.b点是二氧化氮和四氧化二氮浓度相同,但随时间增加,四氧化二氮继续减小,二氧化氮浓度继续增大;
C.图象分析可知b点NO2和 N2O4二者浓度相等;
D.d点二氧化氮和四氧化二氮浓度不变,反应达到平衡状态,二氧化氮生成浓度为0.12mol/L,依据化学方程式计算消耗四氧化二氮浓度为0.06mol/L,转化率=$\frac{消耗量}{起始量}$×100%;
解答 解:A.图象分析可知达到平衡状态前,a点是四氧化二氮浓度减小,二氧化氮浓度增大,反应正向进行,正反应速率大于逆反应速率,故A正确;
B.b点表示的是二氧化氮和四氧化二氮浓度相同,但随后四氧化二氮继续减小,二氧化氮浓度继续增大,反应未达到平衡状态,故B错误;
C.图象分析可知b点表示的是NO2和 N2O4二者浓度相等,故C正确;
D.d点二氧化氮和四氧化二氮浓度不变,反应达到平衡状态,二氧化氮生成浓度为0.12mol/L,四氧化二氮起始量为0.1mol/L,依据化学方程式计算消耗四氧化二氮浓度为0.06mol/L,转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.06mol/L}{0.1mol/L}$×100%=60%,故D错误;
故选AC.
点评 本题考查了化学平衡的建立过程、反应达到平衡的标志分析判断、图象变化的理解应用,掌握基础是解题关键,题目难度中等.


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某单核粒子的核外电子排布为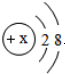 ,则该微粒一定是氖原子 ,则该微粒一定是氖原子 | |
| B. | 原子最外层只有1个电子的元素一定是金属元素 | |
| C. | NH4+与H3O+具有相同的质子数和电子数 | |
| D. | 最外层电子数是次外层电子数2倍的原子容易失去电子成为阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )
长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )| A. | 能发生取代反应、加成反应、消去反应 | |
| B. | 1mol该物质中含有苯环的物质的量为1mol | |
| C. | 该物质在酸性条件下加热水解可以得到乙醇 | |
| D. | 与足量NaOH溶液反应,最多消耗4nmolNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 酸的种类 | 浓度 | 锌的浸取率/% | 锰的浸取率/% |
| 硫酸 | 1:1 | 96.2 | 95.1 |
| 盐酸 | 1:1 | 95.1 | 94.6 |
| 硝酸 | 1:1 | 94.5 | 94.7 |
| 磷酸 | 1:1 | 58.4 | 42.3 |
| 浓度 | 锌的浸取率/% | 锰的浸取率/% |
| 1:1 | 96.2 | 95.1 |
| 1:2 | 90.4 | 88.5 |
| 1:3 | 87.3 | 82.4 |
| Mn(OH)2 | Al(OH)3 | |||||
| 开始沉淀 | 完全沉淀 | 开始沉淀 | 完全沉淀 | 开始溶解 | 完全溶解 | |
| PH | 8.2 | 9.8 | 3.7 | 5.2 | 7.8 | 10.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
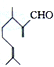 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(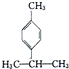 ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 对异丙基甲苯的分子式为C10H14 | |
| B. | 香叶醛的一种同分异构体可能是芳香醇 | |
| C. | 两者互为同分异构体 | |
| D. | 两者均能与溴水反应加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合所得溶液的pH<7 | |
| B. | 反应2CO(g)+2H2(g)→CH3COOH (l)的△S>0 | |
| C. | 冰醋酸用水稀释,溶液中c(H+)先变大后变小 | |
| D. | 含有CH3COOH、C2H5OH、CH3COOC2H5及H2O的平衡体系中加入少量浓硫酸,CH3COOC2H5的物质的量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com