



科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
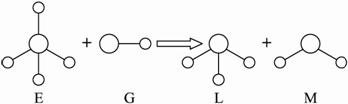
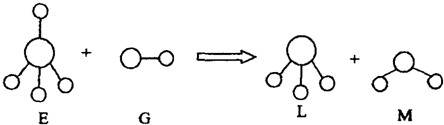
A.E、G、L、M都是10e-微粒?
B.L、M都是极性分子?
C.L能使紫色石蕊试液变蓝色?
D.E离子中质子数一定大于中子数
查看答案和解析>>
科目:高中化学 来源: 题型:
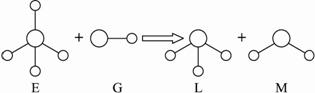
A.E、G、L、M都是10e-微粒?
B.L、M都是极性分子?
C.L能使紫色石蕊试液变蓝色?
D.E离子中质子数一定大于中子数
查看答案和解析>>
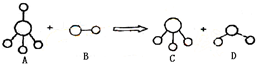
科目:高中化学 来源:2011-2012学年福建省高三第五次质量检测考试理科综合试卷(化学部分) 题型:选择题
已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是

A.分子C与D不能发生化学反应
B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子
C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键
D.在25℃时,A的盐酸盐溶液的pH小于7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com