
| A. | 两元素可形成化合物BA2 | |
| B. | A元素位于元素周期表第二周期第VIA族 | |
| C. | A、B两元素形成的化合物能与碳反应形成单质B | |
| D. | A、B两元素形成的化合物是两性化合物 |
分析 元素A的原子最外层电子数为a,次外层电子数为b,而元素B的原子M层电子数为(a-b),L层电子数为(a+b),则a+b=8,故A原子只能有2个电子层,则b=2,故a=8-2=6,可推知A为氧元素,B元素的M层电子数=6-2=4,则B为Si元素,结合元素化合物性质解答.
解答 解:元素A的原子最外层电子数为a,次外层电子数为b,而元素B的原子M层电子数为(a-b),L层电子数为(a+b),则a+b=8,故A原子只能有2个电子层,则b=2,故a=8-2=6,可推知A为氧元素,B元素的M层电子数=6-2=4,则B为Si元素,
A.A为氧元素、B为Si元素,两元素可形成化合物SiO2,故A正确;
B.A为氧元素,元素位于元素周期表第二周期第VIA族,故B正确;
C.A与B形成的化合物为二氧化硅,与碳反应形成单质硅,故C正确;
D.二氧化硅与氢氧化钠溶液反应生成硅酸钠与水,不能与强酸反应,不是两性化合物,故D错误,
故选D.
点评 本题考查结构性质位置关系应用,根据核外电子排布规律推断元素是解题关键,注意对基础知识的掌握,难度不大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10B20为硼元素的一种原子 | B. | 10B20为硼元素的一种单质 | ||
| C. | 10B的中子数比核外电子数多 | D. | 10B的原子核外电子排布为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用盖斯定律可计算某些难以直接测量的反应焓变 | |
| B. | 如果一个热化学方程式可通过其他几个热化学方程式相加减而得到,则该反应的焓变可由相对应的热化学方程式的焓变相加减而得到 | |
| C. | 当同一个化学反应以不同的途径完成时,反应的焓变也是不同的 | |
| D. | 对于放热反应,放出的热量越多,焓变越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
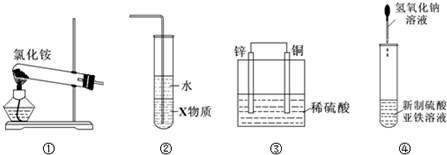
| A. | 实验室用装置①制取氨气 | |
| B. | 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③是原电池,锌电极为负极,发生还原反应 | |
| D. | 装置④可用于制备氢氧化亚铁并观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
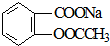 转变为
转变为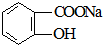 的方法为( )
的方法为( )| A. | 与足量NaOH溶液共热后,再通入CO2 | |
| B. | 与足量NaOH溶液共热后,再加入稀硫酸 | |
| C. | 与稀硫酸共热后,加入足量NaOH溶液 | |
| D. | 与足量稀硫酸共热后,加入足量Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com