
| 时间t/h | 0 | 5 | 10 | 15 | … | 25 | 30 |
| 总压强p/100kPa | P0 | 1.5P0 | 1.75P0 | 1.875P0 | … | 1.95P0 | 1.95P0 |
分析 (1)5h时,压强为1.5P0,温度、体积不变,可知气体的总物质的量为1.5mol,设5h时转化Axmol,则
2A(g)+B(s)?2C(g)+2D (g)
起始(mol)1 0 0
转化(mol)x x x
5h时(mol)1-x x x
1-x+x+x=1.5,x=0.5;
(2)平衡时,压强为1.95P0,可知气体的总物质的量为1.95mol,
2A(g)+B(s)?2C(g)+2D (g)
起始(mol)1 0 0
转化(mol)y y y
5h时(mol)1-y y y
1-y+y+y=1.95,y=0.95,以此计算转化率,计算平衡浓度,可计算平衡常数;
(3)由表中数据可知,每过5h,A的浓度减小一半.
解答 解:(1)5h时,压强为1.5P0,温度、体积不变,可知气体的总物质的量为1.5mol,设5h时转化Axmol,则
2A(g)+B(s)?2C(g)+2D (g)
起始(mol)1 0 0
转化(mol)x x x
5h时(mol)1-x x x
1-x+x+x=1.5,x=0.5,
0-5h时间内,A的平均反应速率为$\frac{\frac{0.5mol}{1L}}{5h}$=0.1 mol/(L•h),5h末A的物质的量浓度为$\frac{1mol-0.5mol}{1L}$=0.5 mol/L,
故答案为:0.1;0.5 mol/L;
(2)平衡时,压强为1.95P0,可知气体的总物质的量为1.95mol,
2A(g)+B(s)?2C(g)+2D (g)
起始(mol)1 0 0
转化(mol)y y y
5h时(mol)1-y y y
1-y+y+y=1.95,y=0.95,
平衡时A的转化率为$\frac{0.95}{1}×100%$=95%,
K=$\frac{0.9{5}^{2}×0.9{5}^{2}}{0.0{5}^{2}}$=325.8,
故答案为:95%;325.8;
(3)由表中数据可知,每过5h,A的浓度减小一半,故答案为:每过5h,A的浓度减小一半.
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析能力、计算能力,注意把握表中数据的分析,难度不大.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
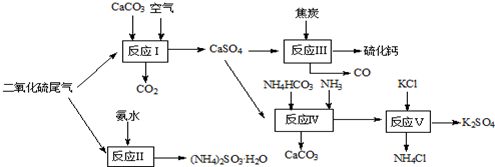
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学课外小组查阅资料得知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应.他们设计了如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中.如图是制取溴苯的装置.试回答:
某化学课外小组查阅资料得知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应.他们设计了如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中.如图是制取溴苯的装置.试回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X、Y、Z为前四周期元素,X的基态原子核外电子有21种运动状态,元素Y的原子最外层电子数是其内层的3倍,Z与X、Y不在同一周期,且Z原子核外p电子比s电子多5个.
元素X、Y、Z为前四周期元素,X的基态原子核外电子有21种运动状态,元素Y的原子最外层电子数是其内层的3倍,Z与X、Y不在同一周期,且Z原子核外p电子比s电子多5个. )裂化生成苯和丙烯.
)裂化生成苯和丙烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com