
| A. | 钢化玻璃 | B. | 玻璃纸 | C. | 有机玻璃 | D. | 水玻璃 |
分析 普通玻璃、钢化玻璃的主要成分是Na2SiO3、CaSiO3、SiO2;
玻璃纸主要成分为醋酸纤维素酯;
有机玻璃主要成分为聚甲烯酸甲酯,属于高分子化合物;据此解答.
解答 解:A.钢化玻璃是将普通玻璃加热到接近玻璃软化温度(600-650℃),经迅速冷却或用化学方法钢化处理所得的玻璃制品.它具有良好的机械性能和耐热震性能,成分与普通玻璃相同,故A不选;
B.玻璃纸的主要原料是棉浆粕.棉浆粕是由棉浆加入烧碱、二硫化碳制成的粘胶.棉浆粕通过喷唇制膜即成玻璃纸,成分与普通玻璃不同,故B选;
C.有机玻璃的成分不是硅酸盐而是有机高分子化合物,与普通玻璃成分不同,故C选;
D.水玻璃是Na2SiO3的水溶液,与普通玻璃成分不同,D选;
故选:BCD.
点评 本题考查了不同材料的成分,明确普通玻璃及各种材料的成分是解题关键,注意对知识积累.


科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、Br- | B. | Fe3+、Mg2+、HCO3-、Cl- | ||
| C. | H+、K+、I-、ClO- | D. | Ag+、NH4+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
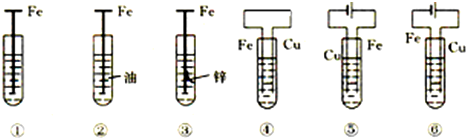
| A. | ③是牺牲阳极的阴极保护法 | |
| B. | 若将⑥的Cu极换成不溶性电极,则⑥是外加电流的阴极保护法 | |
| C. | 腐蚀快到慢的顺序为⑤>④>①>⑥>③>② | |
| D. | ①发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
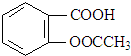
| A. | 阿司匹林的分子式为C9H8O4 | |
| B. | 阿司匹林苯环上的一氯取代物有2种 | |
| C. | 阿司匹林能与NaHCO3溶液反应,最多能与5 mol H2发生加成反应 | |
| D. | 1 mol 阿司匹林与足量NaOH溶液反应,最多消耗NaOH的量为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
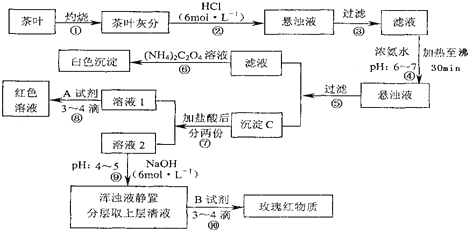
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.56 L甲烷中含有的共价键数为0.1NA | |
| B. | 标准状况下,1mol SO3含有的氧原子数为3NA | |
| C. | 3mol NO2和足量H2O反应,转移1 NA个电子 | |
| D. | pH=1的稀硫酸中含有的H+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 含Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | pH=13的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 强碱性溶液中:K+、Al3+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
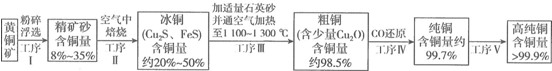
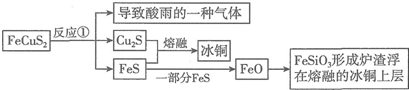
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com