
| A、放电时溶液中的阴离子向正极移动 |
| B、负极反应式为:CH4+10OH--8e-=CO32-+7H2O |
| C、随着放电的进行,溶液的pH不变 |
| D、负极反应式为:O2+2H2O+4e=4OH- |


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
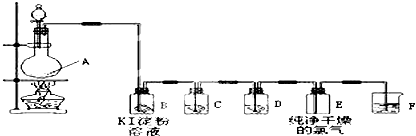
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应速率可用于衡量化学反应进行的快慢 |
| B、化学反应的限度不可改变 |
| C、可逆反应达到化学平衡状态时,正、逆反应速率均为零 |
| D、增大反应物浓度或升高反应温度都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将水加热,Kw增大,pH不变 |
| B、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| C、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| D、向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、参加反应的物质的性质是决定化学反应速率的重要因素 |
| B、反应物分子(或离子)间的每次碰撞是反应的先决条件 |
| C、反应物的分子的每次碰撞都能发生化学反应 |
| D、活化分子具有比普通分子更高的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁管道与直流电源负极相连,防止铁管道腐蚀 |
| B、小苏打、氢氧化铝可用于治疗胃酸过多 |
| C、工业生产中,常将氯气通入澄清石灰水中,制取漂白粉 |
| D、除去氯化钙溶液中少量盐酸,加入足量碳酸钙粉末,充分搅拌再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.15 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com