
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为-241.8 kJ•mol-1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 | |
| C. | 己知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)=2CO(g);△H=b,则a>b | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧生成液态水;
B.醋酸是弱酸,其电离过程是吸热过程;
C.焦炭完全燃烧放出的热量高于不完全燃烧放出的热量;
D.等质量的硫蒸气具有的能量比硫固体多.
解答 解:A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧生成液态水,由热化学方程式可知,氢气的燃烧热<-241.8kJ•mol-1,故A错误;
B.中和热是指稀的强酸和强碱溶液发生中和反应生成1mol水时所放出的热量,醋酸是弱酸,其电离过程是吸热过,40.0g即1molNaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量,故B正确;
C.焦炭完全燃烧放出的热量高于不完全燃烧放出的热量,焓变是负值,即a<b,故C错误;
D.等质量的硫蒸气和硫固体相比较,硫蒸气具有的能量多,因此完全燃烧硫蒸气放出的热量多,故D错误;
故选B.
点评 本题考查学生燃烧热、中和热的概念以及热化学方程式的含义知识,注意教材知识的掌握是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向KBr溶液中加入CCl4和氯水 | CCl4层呈红色 | 氧化性:Cl2>Br2 |
| B | 向难溶的PbSO4加入CH3COONH4溶液 | 得到无色溶液 | (CH3COO)2Pb是弱电解质 |
| C | 向KNO3和KOH的混合溶液中加入Al,微热,关口放湿润的红色石蕊试剂 | 试剂变为蓝色 | NO3-被还原为NH3 |
| D | 高温加热炭粉于Fe2O3的混合物 | 产物能被磁铁吸引 | 产物中含有Fe或Fe3O4中的一种或两种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5KJ/mol,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$ 2H2(g)+O2(g)△H=+285.5KJ/mol | |
| B. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol 则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H=2×(-57.3)KJ/mol | |
| C. | 在CO2中,Mg燃烧生成MgO和C,该反应中化学能全都转化为热能 | |
| D. | 已知AX3的熔点和沸点分别为一93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 KJ/mol.该反应的热化学方程式为AX3(l)+X2(g)═AX5(s)△H=一123.8 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个N2和O2的混合气体中质子数不可能是15NA | |
| B. | 1 L 1 mol•L-1的CH3COONa溶液中CH3COOH和CH3COO-的总数为NA | |
| C. | 58g 分子式为C4H10的有机物中,所含有的甲基数一定为2NA | |
| D. | NA个CH4和NA个Cl2光照下充分反应,被取代的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
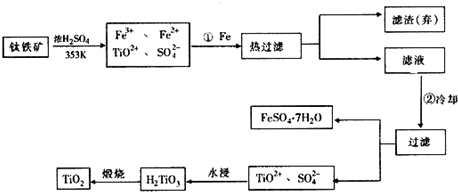
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | 无色溶液中:Fe2+、Na+、ClO-、Cl- | |
| C. | 室温下,$\frac{KW}{c({H}^{+})}$=0.1mol•L-1的溶液中:Na+、K+、SiO32-、NO3- | |
| D. | 滴入KSCN溶液显红色的溶液中:K+、Na+、SO42-、C6H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)>c(H+)>c(OH-)>c(A-) | |
| B. | 中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 | |
| C. | 稀氨水中部分粒子的浓度大小关系:c(NH3•H2O)>c(OH-)>c(NH4+)>c(H+) | |
| D. | 1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)=c(Y-)+c(HY),则HX为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com