
下列情况会对人体造成较大伤害的是
A.用SO2漂白银耳
B.自来水中通入少量氯气消毒杀菌
C.用食醋清洗热水瓶胆内壁附着的水垢(水垢的主要成分为CaCO3、Mg(OH)2)
D.用小苏打(NaHCO3)发酵面粉制作馒头
科目:高中化学 来源:2014-2015江苏省宿迁市三校高一下学期4月月考化学试卷(解析版) 题型:实验题
(10分)氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。为探究氨气的性质,某研 究性学习小组做了以下实验:

(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气。)
①实验室制取氨气的化学方程式为 。
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置B的作用是 。
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有 性。
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O。
已知:①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+。
②在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O。(简述操作方法、现象和结论)
(4)现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。
下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀)===6Cu(NO3)2 + 2NO↑+ 7H2O】___________
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列分子式只能表示一种物质的是
A.C3H7Cl B.CH2Cl2 C.C4H10 D.C2H6O
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省四地六校高一下学期第一次联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.11.2 LO2和O3组成的混合气体含有原子数为NA
B.常温常压下,1.7 g NH3含有的电子数目为 NA
C.0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA
D.标准状况下,22.4 L NO2与足量的H2O充分反应后转移电子数为 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:填空题
(12分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
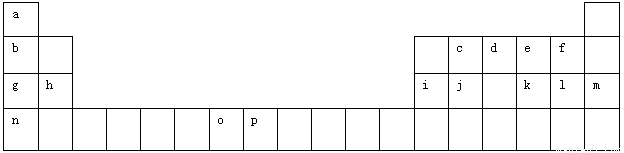
试回答下列问题:
(1)元素p的原子的电子占有 种能量不同的原子轨道。
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为 (用离子符号表示)。
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为______________,该分子是______(填“极性”或“非极性”)分子。
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____________。
(5)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是_____________________________________________________;
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为 ,含有的化学键为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
已知键能N≡N 946 kJ/mol ,H-H 436kJ/mol ,N-H 391 kJ/mol.从理论上计算2NH3(g) N2(g)+3H2(g)的⊿H为
N2(g)+3H2(g)的⊿H为
A.-46 kJ/mol B.-92 kJ/mol
C.+92 kJ/mol D.+1800kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省高一3月月考化学试卷(解析版) 题型:填空题
(6分)现有0.1 mol·L-1的Na2SO4和0.1 mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2 mol·L-1的 Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略混合过程中的体积变化)
(1)当加入50 mLBa(OH)2溶液时,所得溶液中的溶质是 ,其物质的量浓度为 mol·L-1。
(2)当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液中溶质为 ,则该溶质物质的量浓度为 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D. Cl与
Cl与 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com