
【题目】现有一种锂离子二次电池,其工作原理如图。放电时生 成的Li2CO3固体和碳储存于碳纳米管中。下列说法错误的是
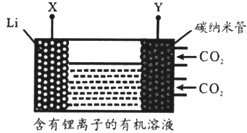
A. 该电池中的有机溶剂不能含活性较大的氢
B. 充电时,Y为阳极,Li+向X电极移动
C. 放电时,负极反应为2Li+CO32-—2e-===Li2CO3
D. 放电时,电池总反应为3CO2+4Li===2Li2CO3+C
【答案】C
【解析】
A、锂是活泼金属;
B、充电时阳极发生氧化反应,Y为阳极,Li+向X电极移动;
C、放电时,负极反应为Li—e-=Li+;
D、放电时,锂作还原剂,二氧化碳作氧化剂,电池总反应为3CO2+4Li===2Li2CO3+C;
A、锂是活泼金属,该电池中的有机溶剂不能含活性较大的氢,否则锂会与有机溶剂发生反应,故A正确;
B、充电时阳极发生氧化反应,Y为阳极,Li+向阴极X电极移动,故B正确;
C、放电时,碳酸根离子不能通过有机溶剂,负极反应为Li—e-=Li+,故C错误;
D、放电时,锂作还原剂,二氧化碳作氧化剂,电池总反应为3CO2+4Li===2Li2CO3+C,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】在100℃时,将0.200 mol的四氧化二氮气体充入2 L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如下表格:
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应达到平衡时,四氧化二氮的转化率为__________%,表中c2_____c3、a_____b(填“>”、“<”或“=”)。
(2)20s时四氧化二氮的浓度c1=_________mol/L,在0 s~20 s时间段内,四氧化二氮的平均反应速率为______________mol/(L·s)。
(3)100℃时,该反应的平衡常数K = ______________________
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是

物质 选 项 | a | b | c |
A | Al | AlCl3 | Al(OH)3 |
B | CH3CH2OH | CH3CH2Br | CH3COOH |
C | CH3CH2OH | CH3COOH | CH3COOC2H5 |
D | CH3CH2Br | CH3CH2OH | CH3CHO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,对碳、氮及化合物的研究备受关注。已知:
I.2C(s)+2NO(g)![]() N2(g)+2CO(g)
N2(g)+2CO(g) ![]() =-414.8kJ/mol
=-414.8kJ/mol
II.2CO(g)+O2(g)![]() 2CO2 (g)
2CO2 (g)![]() =-566kJ/mol
=-566kJ/mol
III.2CO(g)+2NO(g)![]() N2(g)+2CO2 (g)
N2(g)+2CO2 (g)![]() =-759.8kJ/mol
=-759.8kJ/mol
回答下列问题:
(l) N2的电子式为 ___ 。
(2)表示碳的燃烧热的热化学方程式为____。
(3)某催化剂的M型、N型均可催化反应2CO(g)+O2 (g)=2CO2 (g)。向容积相同的恒容密闭容器中分别充入等量的CO和O2,在相同时间段内,不同温度下测得CO的转化率(a)如图所示。

①由图推断下列说法正确的是 ___(填选项字母)。
A.a、b、c、d点均达到平衡状态B.该反应的平衡常数K(b)=K(c)
C.b点反应物的有效碰撞几率最大D.图中五个点对应状态下,a点反应速率最慢
②e点CO的转化率突然减小的可能原因为_______________________
③若b点容器中c(O2)=0.5 mol·L-l,则To℃时该反应的平衡常数K=________
(4) T1℃时,向刚性容器中充入2 mol NO和2 mol CO,发生反应Ⅲ。5 min时达到平衡状态,测得容器中n(N2) =0.8 mol、c(CO2)=0. 32 mol/L。
①0~5 min内,用NO表示的反应速率v(NO)=_________
②反应进行到2 min时,v正(CO) ___v逆(CO2)(填“>”“<”或“=”)。
③若升高温度,容器内气体压强____(填“增大”“减小”或“不变”),原因为 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 钠和钾的合金在常温下是液体,可用于快中子反应堆的热交换剂
B. 氯化铁、硫酸铁是优良的净水剂
C. 碳酸钡可作为检查肠胃的内服药剂,俗称“钡餐”
D. 乙醇可以直接作为燃料,也可以和汽油混合后作发动机燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需精确配制480mL0.100mol/L的CuSO4溶液,以下操作正确的是
A.称取7.68gCuSO4,配成500mL溶液
B.称取12.0g胆矾,配成500mL溶液
C.称取8.0gCuSO4,加入500mL水
D.称取12.5g胆矾,配成500mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂),我国卫生部规定实验中黄血盐的最大使用量为10mg/kg。一种制备黄雪盐的工艺如下:

回答下列问题:
(1)步骤Ⅰ反应的化学方程式为__________________________。
(2)步骤Ⅳ过滤所得的废液中含量较多的溶质为____________(填化学式)。
(3)步骤Ⅴ所用的试剂X是___________。(填化学式)
(4)工艺中用到剧毒的HCN溶液,含CN- 的废水必须处理后才能排放。
已知: HCN是一种具有苦杏仁味的无色剧毒液体,易挥发,25℃时Ka(HCN)=6.25×10-10;溶液中H2CO3、HCO3-、CO32-的存在与溶液pH的关系如图所示:
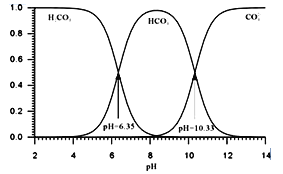
①NaCN的电子式为___________。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐。第一步控制强碱性的主要目的是_______,第二步反应的离子方程式为____________。
(5)已知蓝色染料普鲁士蓝的合成方法如下:

用硫酸亚铁碱性试纸可以检验食品中是否含有CN-,方案如下:

若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请解释检测时试纸变蓝的原因:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。同温下将等质量的氢气与氦气同时充入容器,符合实际情况的是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com