
科目:高中化学 来源: 题型:
| ||
. |
| ||
. |
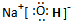
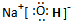
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①②④ | C、①②④⑤ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源:2010年北京市东城区高三第二次模拟考试(理综)化学部分 题型:填空题
(16分)
短周期元素A、B、C、D、E原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙;D与A位于同一主族;在同周期元素形成的简单离子中,E的离子半径最小。
(1)实验室中可用A2C2制取C单质,其化学方程式是 。
(2)由A、C、D三种元素组成的化合物的电子式是 ;B、C、E三种元素组成的常见盐的水溶液呈酸性,原因是 (用离子方程式表示)。
(3)常温下,若甲、丙两溶液的pH均等于5,则由水电离出的c(H+)甲:c(H+)丙= ;丙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(4)0.1molD单质和0.2molE单质组成的混合物投入到足量的A2C中,产生气体的体积(标准状况)是 。
(5)反应乙+C2→B2+A2C(未配平)可设计为燃料电池,则通入乙的电极是 (填“正”或“负”)极,在碱性条件下其电极反应是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com