
分析 (1)Fe元素的化合价有+3→+6失去3个电子,化合价升3,而 Cl元素则有0→-1价,氯气分子中含有2个Cl,则化合价至少降低2价,先根据元素化合价升降相等配平,然后用单线桥法标出电子转移情况;
(2)氧化剂在反应中得到电子,化合价降低被还原,氧化剂对应产物为还原产物.
解答 解:(1)该反应前后Fe元素的化合价有+3→+6失去3个电子,化合价升3,而 Cl元素则有0→-1价,氯气分子中含有2个Cl,则化合价至少降低2价,所以化合价变化的最小公倍数为6,Fe(NO3)3前的系数=$\frac{6}{3}$=2,Cl2前的系数=$\frac{6}{2}$=3,再通过质量守恒定律,配平该反应的化学方程式为:
2 Fe(NO3)3+16 NaOH+3Cl2=2 Na2FeO4 +6 NaNO3 +6 NaCl+8 H2O,用单线桥法标出电子转移情况为: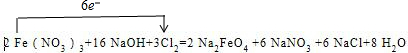 ,
,
故答案为: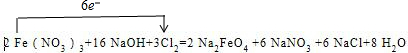 ;
;
(2)反应2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4 +6NaNO3 +6NaCl+8H2O中,Fe(NO3)3为Fe元素化合价升高被氧化,作还原剂,Cl2在反应中化合价降低被还原生成NaCl,作氧化剂,还原产物为NaCl,
故答案为:Cl2;NaCl.
点评 本题考查了氧化还原反应的配平,题目难度中等,明确氧化还原反应的实质、特征为解答关键,注意掌握化合价升降法配平氧化还原反应的方法,试题有利于培养学生的分析能力及灵活应用能力.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:解答题
 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:| 元素 | 相关信息 |
| T | 基态原子2p能级有3个单电子 |
| W | 基态原子p轨道上成对电子数等于未成对电子数 |
| X | 氢化物常用于刻蚀玻璃 |
| Y | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
| Z | 原子序数等于X与Y的原子序数之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) c(CH3COO-)c(CH3COOH) | |
| C. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

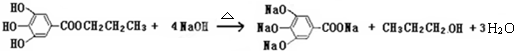
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,该反应的热化学方程式是 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.4 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石一定比石墨稳定 | |
| C. | 已知:断裂1mol H2(g)、1molCl2(g)、1molHCl(g)中化学键吸收的能量分别是E1、E2、E3,则H2(g)+Cl2 (g)=2HCl(g)的反应热△H=2×E3-(E1+E2) | |
| D. | 已知C(s)+O2(g)=CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g),△H=b kJ•mol-1,则2CO(g)+O2(g)=2CO2(g)△H=(2a-b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(W)=3v(Z) | B. | 2v(X)=3v(Z) | C. | 2v(X)=v(Y) | D. | 2v(W)=3v(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②③④⑤ | C. | ①②③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Zn | Ag | C | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com