
【题目】把在空气中久置的镁条7.2 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
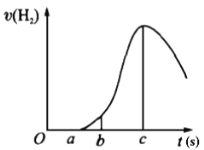
(1)曲线由0→a段不产生氢气的原因________,有关的离子方程式为______________;
(2)曲线由b→c段,产生氢气的速率逐渐增大的主要原因________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因________________。
(4)在b到c这段时间内,收集到氢气V L(标准状况),则这段时间内用硫酸表示的平均速率为________mol/(L·s)(假设反应前后溶液体积不变)。
(5)对于足量镁条和100 mL 2 mol/L硫酸生成氢气的反应,下列措施能减缓反应速率,但又不影响生成氢气的总量的是________。
①加NaOH固体;②加BaCl2溶液;③加KNO3溶液;④加H2O;⑤加CH3COONa固体;⑥加小苏打溶液;⑦加少量CuSO4溶液;⑧加Na2SO4溶液;⑨将2 mol/L硫酸换成160 mL 2.5 mol/L的盐酸;⑩将镁条换成镁粉。
【答案】镁条表面有氧化镁,硫酸首先和与表面的氧化镁反应,不产生氢气 MgO+2H+=Mg2++H2O 镁和硫酸反应放出的热量使溶液温度升高而加快反应速率 随着反应的进行,硫酸的浓度逐渐变小,该因素变为影响反应速率的主要因素,使反应速率减小 ![]() ②④⑤⑧⑨
②④⑤⑧⑨
【解析】
(1)根据镁条表面有氧化镁,硫酸首先和与表面的氧化镁反应,不产生氢气进行分析;
(2) (3)根据反应过程中有硫酸的浓度变化和反应体系的温度变化分析;
(4)根据氢气的生成量计算硫酸的消耗量,从而计算速率。
(5)根据过程中氢离子的浓度和氢离子的物质的量的变化进行分析,注意原电池等影响。
(1)镁条表面有氧化镁,硫酸首先和与表面的氧化镁反应,不产生氢气,所以开始没有气体产生,反应的离子方程式为:MgO+2H+=Mg2++H2O;
(2) 随着反应的进行,硫酸的浓度减小,反应放热,温度升高,b→c段反应速率加快,说明是镁和硫酸反应放出的热量使溶液温度升高而加快反应速率;
(3) 随着反应的进行,硫酸的浓度逐渐变小,反应放热,温度升高,c后反应速率减慢,说明该阶段浓度为影响反应速率的主要因素,使反应速率减小;
(4) 在b→c段时间内,收集到氢气V L(标准状况),即氢气的物质的量为![]() mol,则硫酸的消耗的物质的量为
mol,则硫酸的消耗的物质的量为![]() mol,浓度改变量为
mol,浓度改变量为![]() mol/L,反应速率为
mol/L,反应速率为 ![]() mol/(L·min);
mol/(L·min);
(5) ①加NaOH固体消耗硫酸,H+物质的量和浓度都减小,反应速率减慢,产生氢气的量减小;②加BaCl2溶液,反应生成硫酸钡沉淀和盐酸,溶液的体积变大,氢离子浓度减小,速率减慢,不影响氢气的量;③加KNO3溶液,NO3-酸性条件下具有强氧化性,与镁反应不产生氢气;④加H2O,硫酸浓度减小,速率减慢,不影响氢气的量;⑤加CH3COONa固体,与硫酸反应生成醋酸,氢离子浓度减小,速率减慢,不影响氢气的量;⑥加小苏打溶液,与硫酸反应生成硫酸钠、水和二氧化碳,H+物质的量和浓度都减小,反应速率减慢,产生氢气的量减小;⑦加少量CuSO4溶液,镁和硫酸铜反应生成铜,形成原电池,反应速率加快;⑧加Na2SO4溶液,硫酸浓度减小,速率减慢,不影响氢气的量;⑨将2 mol/L硫酸换成160 mL 2.5 mol/L的盐酸,氢离子浓度减小,但氢离子总量不变,速率减慢,不影响氢气的总量;⑩将镁条换成镁粉,反应速率加快。故速率减慢不影响氢气的量的为:②④⑤⑧⑨。


科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
请回答钢铁在腐蚀、防护过程中的有关问题。
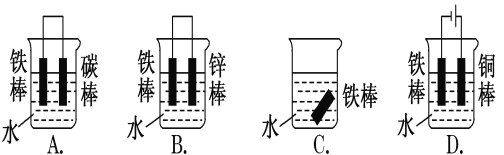
(1)下列哪些装置不能防止铁棒被腐蚀________________;
(2)实际生产可在铁件的表面镀铜防止铁被腐蚀.装置示意图如图.请回答:
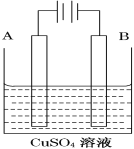
①B电极对应的金属是________(写元素名称),
A电极的电极反应式是___________________。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A(?) ![]() B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
A.升高温度,正反应速率增大,逆反应速率减小B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应D.若向容器中充入惰性气体,则平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明乙烯能被酸性KMnO4溶液氧化,某小组按下图装置制备乙烯并检验其化学性质。完成下列填空:
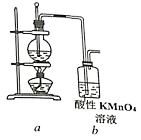
(1)首先检验该装置气密性。检验气密性的操作是:_____________。
(2)向圆底烧瓶中加入药品的顺序是:先加入_____,再缓慢加入____,最后再加入几粒碎瓷片。
(3)加热圆底烧瓶,使温度迅速上升到________℃,观察到烧瓶中的无色液体逐渐变黑。该黑色的物质是_______。
(4)酸性KMnO4溶液很快褪色,但不能说明乙烯具有还原性。理由是:_______________。
(5)选用下列装置(可重复使用也可不用)来证明乙烯具有还原性,请将装置按编号依次排列,并在装置序号对应位置的下一行写出装置内所放的药品。
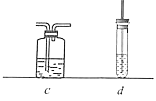
装置a→_____________________________→b。
药品:(a药品略)_________________________(b酸性KMnO4溶液)。
(6)若将b中酸性KMnO4溶液换成溴水,溴水也能褪色且可观察到b底部有少量无色油状液体生成,如何通过实验证明该无色油状液体中含有溴元素?______。如何通过实验证明乙烯和溴水发生的是加成反应而不是取代反应?____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为VL的容器中充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。
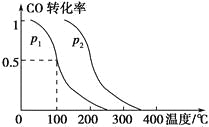
①p1________p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加amol CO与2amol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”,下同),平衡常数________。
(3)已知在T℃时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________,此时刻υ正________υ逆(填“>”或“<”)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________,此时刻υ正________υ逆(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CrCl3·6H2O是中学化学中的常见物质,工业上用铬酸钠(Na2CrO4)来制备。某兴趣小组以实验室中的红矾钠(Na2Cr2O7)为原料来制备CrCl3·6H2O。流程如下:

已知:
a.CrCl3·6H2O不溶于乙醚,易溶于水、乙醇、易水解。
b.CrCl3·6H2O易升华,在高温下能被氧化。
(1)步骤Ⅰ中加入40%NaOH的目的是__________________________。步骤1中甲醇作为还原剂,反应后生成CO2,请写出反应的离子方程式_________________________。
(2)步骤Ⅲ,请补充完整由步骤Ⅱ得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:
ⅰ:将过滤后所得固体溶解于过量的盐酸中,ⅱ: ,ⅲ:过滤,ⅳ:洗涤,ⅴ:干燥,得到CrCl3·6H2O。
①操作ⅱ为_________________________________。
②操作ⅳ最合适的洗涤剂是_____________。
A.乙醇 B.乙醚 C.冷水
③操作ⅴ应选择的干燥方式为_____________。
(3)样品中三氯化铬质量分数的测定
称取样品,加水溶解并定容于容量瓶中。移取一定体积溶液于碘量瓶(一种带塞的锥形瓶)中,加入Na2O2,在一定条件下充分反应后,适当稀释,然后加入过量的稀H2SO4至溶液呈强酸性,此时铬以![]() 存在。充分加热煮沸后,加入KI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用硫代硫酸钠溶液滴定至终点。
存在。充分加热煮沸后,加入KI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用硫代硫酸钠溶液滴定至终点。
①充分加热煮沸的原因是 _______________________。
②在使用硫代硫酸钠溶液滴定过程中使用到碱式滴定管,选出其正确操作并按顺序列出字母:蒸馏水洗涤→加入待量液3~5mL→_____→_____→_____→_____→_____→滴定,进行实验。
a.加液至“0”刻度以上2~3cm
b.倾斜转动滴定管,使液体润湿滴定管内壁,挤压玻璃球,放液
c.调整至“0”或“0”刻度以下,静止1min,读数
d.将滴定管尖端插入锥形瓶内约1cm
e.将滴定管尖端对准锥形瓶,且置于锥形瓶口上方约1cm处
f.右手拿住滴定管使它倾斜30°,左手迅速打开活塞
g.橡皮管向上弯曲,挤压玻璃球,放液
③下图是碱式滴定管的内部构造,滴定时,左手应该捏住乳胶管中玻璃球的______部位(填“a”、“b”或“c”),挤捏乳胶管,使其与玻璃球之间形成一条缝隙,溶液即可流出。
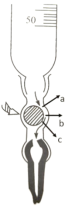
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1mol·L-1的FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。试回答下列问题:
(1)其中操作正确的同学是____。
(2)Fe(OH)3胶体制备的化学方程式为_____。
(3)证明有Fe(OH)3胶体生成利用的胶体性质是_____。
(4)利用Fe(OH)3胶体进行实验:
①将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极附近的颜色逐渐变深,这表明Fe(OH)3胶体粒子带____(填“正”或“负”)电荷。
②若向其中加入浓盐酸溶液,产生的现象是_____,用必要的文字和有关的离子方程式解释此现象_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL0.1molL-1HX溶液中逐滴加入0.2molL-1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论错误的是( )
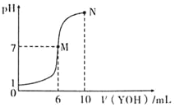
A.HX为一元强酸,YOH为一元弱碱
B.M点水的电离程度大于N点水的电离程度
C.N点对应溶液中粒子浓度:c(YOH)>c(Y+)>c(X-)>c(H+)>c(OH-)
D.25℃时pH=a的YX溶液中水电离出的c(H+)=1.0×10-amolL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com