
”¾ĢāÄæ”æĒāĘųŹĒŅ»ÖÖĄķĻėµÄĀĢÉ«ÄÜŌ“”£
£Ø1£©ŌŚ101KPĻĀ£¬1gĒāĘųĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®·Å³ö142.9kJµÄČČĮ棬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁĒāĘųµÄČ¼ÉÕČČĪŖ________________
¢ŚøĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ_____________________
£Ø2£©ĒāÄÜµÄ“ę“¢ŹĒĒāÄÜĄūÓƵÄĒ°Ģį£¬æĘѧ¼ŅŃŠ¾æ³öŅ»ÖÖ“¢ĒāŗĻ½šMg2Ni£¬ŅŃÖŖ£ŗMg(s)£«H2(g)=MgH2(s)¦¤H1£½£74.5kJ”¤mol£1,Mg2Ni(s)£«2H2(g)=Mg2NiH4(s)¦¤H2,Mg2Ni(s)£«2MgH2(s)=2Mg(s)£«Mg2NiH4(s) ¦¤H3£½+84.6kJ”¤mol£1,Ōņ¦¤H2£½____________kJ”¤mol£1”£
”¾“š°ø”æ-285.8 kJ”¤mol£12H2(g)+ O2(g)= 2H2O(l)¦¤H£½£571.6kJ”¤mol£1£64.4kJ”¤mol£1
”¾½āĪö”æ
£Ø1£©¢ŁŹµŃé²āµĆ£¬1gĒāĘųČ¼ÉÕÉś³ÉŅŗĢ¬Ė®·Å³ö142.9kJČČĮ棬1molĒāĘų£Ø¼“2g£©ĶźČ«·“Ӧɜ³ÉŅŗĢ¬Ė®·ÅČČĪŖ285.5kJ£¬ŌņĒāĘųµÄČ¼ÉÕČČ285.5kJ/mol£»ÕżČ·“š°ø£ŗ 285.5kJ/mol”£
¢ŚŌņ±ķŹ¾ĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗH2(g)+![]() O2(g)=H2O(l)”÷H=-285.8kJ/mol»ņ2H2(g)+ O2(g)= 2H2O(l) ¦¤H£½£571.6kJ/mol£»ÕżČ·“š°ø£ŗ H2(g)+
O2(g)=H2O(l)”÷H=-285.8kJ/mol»ņ2H2(g)+ O2(g)= 2H2O(l) ¦¤H£½£571.6kJ/mol£»ÕżČ·“š°ø£ŗ H2(g)+![]() O2(g)=H2O(l)”÷H=-285.8KJ/mol»ņ2H2(g)+ O2(g)= 2H2O(l) ¦¤H£½£571.6kJ/mol£»
O2(g)=H2O(l)”÷H=-285.8KJ/mol»ņ2H2(g)+ O2(g)= 2H2O(l) ¦¤H£½£571.6kJ/mol£»
£Ø2£©¢ŁMg(s)£«H2(g)=MgH2(s)¦¤H1£½£74.5kJ”¤mol£1£»¢ŚMg2Ni(s)£«2MgH2(s)=2Mg(s)£«Mg2NiH4(s) ¦¤H3£½+84.6kJ”¤mol£1, ÓÉøĒĖ¹¶ØĀÉ2”Į¢Ł+¢ŚµĆµ½Mg2Ni(s)+2H2(g)ØTMg2NiH4(s) ”÷H2=(-74.5kJ/mol)”Į2+(84.6kJ/mol)=-64.4kJ/mol£¬Ōņ”÷H2=-64.4kJ/mol£»ÕżČ·“š°ø£ŗ£64.4kJ”¤mol£1 ”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø»Æѧ”Ŗ”ŖŃ”ŠŽ5£ŗÓŠ»ś»Æѧ»ł“”£©
»ÆŗĻĪļGŹĒŅ»ÖÖÓŠ»ś¹āµē²ÄĮĻÖŠ¼äĢ唣ÓÉAÖʱøGµÄŅ»ÖÖŗĻ³ÉĀ·ĻßČēĻĀĶ¼ĖłŹ¾£ŗ
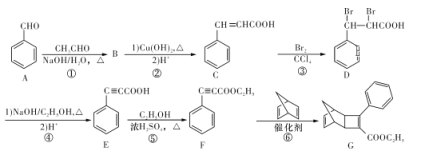
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©FÖŠ¹ŁÄÜĶŵÄĆū³ĘĪŖ___________”£
£Ø2£©BµÄ·Ö×ÓŹ½ĪŖC9H8O£¬B”śCµÄ¹ż³ĢÖŠµŚŅ»²½·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_________________”£
£Ø3£©·“Ó¦¢Ś”«¢ŽÖŠŹōÓŚČ”“ś·“Ó¦µÄŹĒ___________(ĢīŠņŗÅ)”£
£Ø4£©ŌŚÄųµÄ“ß»Æ×÷ÓĆĻĀ£¬EÓė×ćĮæµÄĒāĘų¼Ó³ÉĖłµĆµÄ²śĪļ·Ö×ÓÖŠÓŠ___________ÖÖ²»Ķ¬»·¾³µÄĒāŌ×Ó”£
£Ø5£©Ņ»¶ØĢõ¼žĻĀŅŌFĪŖµ„Ģå·¢Éś¼Ó¾ŪµÄ·“Ó¦·½³ĢŹ½ĪŖ___________”£
£Ø6£©CÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬ĘäÖŠĶ¬Ź±Āś×ćĻĀĮŠĢõ¼žµÄĶ¬·ÖŅģ¹¹ĢåÓŠ_________ÖÖ”£
¢ŁÄÜ·¢ÉśŅų¾µ·“Ó¦£»
¢ŚÄÜ·¢ÉśĖ®½ā·“Ó¦£»
¢ŪÄÜÓėäåµÄCCl4ČÜŅŗ·¢Éś¼Ó³É·“Ó¦£»
¢ÜŹōÓŚ·¼Ļć×å»ÆŗĻĪļ”£
£Ø7£©ĒėŠ“³öŅŌ![]() ŗĶCH3C”ŌCHĪŖŌĮĻÖʱø
ŗĶCH3C”ŌCHĪŖŌĮĻÖʱø![]() µÄŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼(ĪŽ»śŹŌ¼ĮČĪÓĆ£¬ŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼Ź¾Ąż¼ū±¾ĢāĢāøÉÖŠŗĻ³ÉĀ·Ļß)”£____________
µÄŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼(ĪŽ»śŹŌ¼ĮČĪÓĆ£¬ŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼Ź¾Ąż¼ū±¾ĢāĢāøÉÖŠŗĻ³ÉĀ·Ļß)”£____________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ²»Ķ¬ĪĀ¶ČĻĀ£¬ĻņV LĆܱÕČŻĘ÷ÖŠ¼ÓČė0.5 mol NOŗĶ0.5 mol»īŠŌĢ棬·¢Éś·“Ó¦£ŗ
2NO(g)+C(s)![]() N2(g)+CO2(g) ”÷H= ”ŖQ kJ”¤mol-1(Q>0)£¬“ļµ½Ę½ŗāŹ±µÄŹż¾ŻČēĻĀ£ŗ
N2(g)+CO2(g) ”÷H= ”ŖQ kJ”¤mol-1(Q>0)£¬“ļµ½Ę½ŗāŹ±µÄŹż¾ŻČēĻĀ£ŗ
ĪĀ¶Č£Æ”ę | n (C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ
A. ÓÉÉĻŹöŠÅĻ¢æÉĶĘÖŖ£ŗT1 > T2
B. T2”ꏱ£¬Čō·“Ó¦“ļĘ½ŗāŗóŌŁĖõŠ”ČŻĘ÷µÄĢå»ż£¬c (N2)£ŗc (NO)Ōö“ó
C. T1”ꏱ£¬ČōæŖŹ¼Ź±·“Ó¦ĪļµÄÓĆĮæ¾ł¼õŠ”Ņ»°ė£¬Ę½ŗāŗóNOµÄ×Ŗ»ÆĀŹŌö“ó
D. T1”ꏱ£¬øĆ·“Ó¦µÄĘ½ŗā³£Źż![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌŗćĪĀŗćČŻĆܱÕČŻĘ÷ÖŠµÄæÉÄę·“Ó¦£ŗA(g)£«3B(g)![]() 2C(g) H <0£¬ĻĀĮŠ“ķĪóµÄŹĒ( ””)
2C(g) H <0£¬ĻĀĮŠ“ķĪóµÄŹĒ( ””)
A. ÉżøßĪĀ¶Č£¬v(Õż)”¢v(Äę)¶¼Ōö“󣬵«v(Äę)Ōö¼ÓµÄ³Ģ¶Čøü“ó
B. Ōö“óŃ¹Ē棬v(Õż)”¢v(Äę)¶¼Ōö“󣬵«v(Õż)Ōö¼ÓµÄ³Ģ¶Čøü“ó
C. Ōö“óAµÄÅØ¶Č£¬v(Õż)»įŌö“󣬵«v(Äę)»į¼õŠ”
D. Ź¹ÓĆ“ß»Æ¼Į£¬Ņ»°ćv(Õż)”¢v(Äę)Ķ¬Ź±Ōö“󣬶ųĒŅŌö“óµÄ±¶ŹżĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø10·Ö£©”¢·“Ó¦A(g)+B(g)![]() C(g) +D(g)¹ż³ĢÖŠµÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā”£
C(g) +D(g)¹ż³ĢÖŠµÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā”£

(1)øĆ·“Ó¦ŹĒ____________________·“Ó¦(Ģī”°ĪüČČ”±”°·ÅČČ”±);
(2)µ±·“Ó¦“ļµ½Ę½ŗāŹ±£¬ÉżøßĪĀ¶Č£¬AµÄ×Ŗ»ÆĀŹ______(Ģī”°Ōö“ó”±”°¼õŠ””±”°²»±ä”±)£¬ŌŅņŹĒ_______________________________£»
(3)·“Ó¦ĢåĻµÖŠ¼ÓČė“߻ƼĮ¶Ō·“Ó¦ČČŹĒ·ńÓŠÓ°Ļģ?________£¬ŌŅņŹĒ_________£ŗ
(4)ŌŚ·“Ó¦ĢåĻµÖŠ¼ÓČė“߻ƼĮ£¬·“Ó¦ĖŁĀŹŌö“ó£¬E1ŗĶE2µÄ±ä»ÆŹĒ£ŗE1_________£¬E2________(Ģī”°Ōö“ó”±”°¼õŠ””¢”±”°²»±ä”±)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĶ¼Ź¾Óė¶ŌÓ¦µÄŠšŹöÕżČ·µÄŹĒ

A. Ķ¼¼×±ķŹ¾ÓŠĪŽ“߻ƼĮµÄ·“Ó¦£¬¼Ó“߻ƼĮæÉŅŌøı䷓ӦµÄģŹ±ä
B. Ķ¼ŅŅ±ķŹ¾µČÅØ¶ČµČĢå»żµÄNaCl”¢NaBr¼°NaIČÜŅŗ·Ö±šÓĆAgNO3ČÜŅŗµĪ¶ØĒśĻߣ¬aĪŖCl£
C. Ķ¼±ū±ķŹ¾µČÅØ¶ČµČĢå»żµÄŃĪĖįŗĶ“×Ėį·Ö±šÓĆNaOHČÜŅŗµÄµĪ¶ØĒśĻߣ¬ÖøŹ¾¼Į¶¼æÉÓĆ·ÓĢŖ
D. Ķ¼¶”±ķŹ¾·“Ó¦2CO(g)£«2NO(g)![]() N2(g)£«2CO2(g)£¬ŌŚĘäĖūĢõ¼ž²»±äŹ±£¬øıäĘšŹ¼COµÄĪļÖŹµÄĮæ£¬Ę½ŗāŹ±N2µÄĢå»ż·ÖŹż±ä»Æ£¬ÓÉĶ¼æÉÖŖNOµÄ×Ŗ»ÆĀŹb£¾c£¾a
N2(g)£«2CO2(g)£¬ŌŚĘäĖūĢõ¼ž²»±äŹ±£¬øıäĘšŹ¼COµÄĪļÖŹµÄĮæ£¬Ę½ŗāŹ±N2µÄĢå»ż·ÖŹż±ä»Æ£¬ÓÉĶ¼æÉÖŖNOµÄ×Ŗ»ÆĀŹb£¾c£¾a
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄʵē³ŲÓÉÓŚĘäæģĖŁ³ä·ÅµēµÄĢŲŠŌŹÜµ½æĘŃŠ¹¤×÷ÕßµÄÖŲŹÓ£¬Ä³ÄĘĄė×ÓīŃ»łµē³Ųµē³Ų½į¹¹ČēĶ¼ĖłŹ¾£¬µē½āÖŹĪŖŗ¬ÄĘĄė×ÓµÄøß¾ŪĪļ£¬ŅŃÖŖµē³ŲµÄ·“Ó¦·½³ĢŹ½ĪŖ2NaxCn+xNaTi2(PO4)3![]() 2nC+ xNa3Ti2(PO4)3”£ĻĀĮŠ¹ŲÓŚøƵē³ŲĖµ·ØÕżČ·µÄŹĒ
2nC+ xNa3Ti2(PO4)3”£ĻĀĮŠ¹ŲÓŚøƵē³ŲĖµ·ØÕżČ·µÄŹĒ

A. ·ÅµēŹ±µē³ŲÕż¼«ĪŖNaxCn B. ·ÅµēŹ±Na+Ļņµē¼«¢ņŅʶÆ
C. ³äµēŹ±Ńō¼«·“Ó¦£ŗNaxCn-xe-=nC+xNa+ D. ³äµēŹ±µē¼«¢ńÓėĶāµēŌ“Õż¼«ĻąĮ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫µČĪļÖŹµÄĮæµÄA”¢B»ģŗĻÓŚ2 LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśĻĀĮŠ·“Ó¦£ŗ3A(g)£«B(g)xC(g)£«2D(g)£¬¾2 minŗó²āµĆDµÄÅضČĪŖ0.5 mol”¤L-1£¬c(A)”Ćc(B)£½3”Ć5£¬ŅŌC±ķŹ¾µÄĘ½¾łĖŁĀŹv(C)£½0.25 mol”¤L-1”¤min-1£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(”” ””)
A. øĆ·“Ó¦·½³ĢŹ½ÖŠ£¬x£½1 B. 2 minŹ±£¬AµÄĪļÖŹµÄĮæĪŖ0.75 mol
C. 2 minŹ±£¬AµÄ×Ŗ»ÆĀŹĪŖ50% D. ·“Ó¦ĖŁĀŹv(B)£½0.25 mol”¤L-1”¤min-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚČŻ»żĪŖ1.00LµÄČŻĘ÷ÖŠ£¬ĶØČėŅ»¶ØĮæµÄN2O4£¬·¢Éś·“Ó¦N2O4(g)![]() 2NO2(g)£¬ĖęĪĀ¶ČÉżøߣ¬»ģŗĻĘųĢåµÄŃÕÉ«±äÉī”£»Ų“šĻĀĮŠĪŹĢā£ŗ
2NO2(g)£¬ĖęĪĀ¶ČÉżøߣ¬»ģŗĻĘųĢåµÄŃÕÉ«±äÉī”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©·“Ó¦µÄ”÷H______0£ØĢī”°“óÓŚ”±”°Š”ÓŚ”±£©£»100”ꏱ£¬ĢåĻµÖŠø÷ĪļÖŹÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£ŌŚ0~60sŹ±¶Ī£¬·“Ó¦ĖŁĀŹv(N2O4)ĪŖ________molL-1s-1£¬·“Ó¦µÄĘ½ŗā³£ŹżK1ĪŖ_________
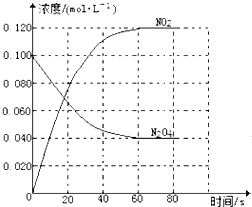
£Ø2£©100”ꏱ“ļµ½Ę½ŗāŗó£¬øı䷓ӦĪĀ¶ČĪŖT£¬c(N2O4)ŅŌ0.0020molL-1s-1µÄĘ½¾łĖŁĀŹ½µµĶ£¬¾10sÓÖ“ļµ½Ę½ŗā”£
¢ŁT_______100”ę£ØĢī”°“óÓŚ”±”°Š”ÓŚ”±£©£¬ÅŠ¶ĻĄķÓÉŹĒ_____________________”£
¢ŚĮŠŹ½¼ĘĖćĪĀ¶ČTŹ±·“Ó¦µÄĘ½ŗā³£ŹżK2 =________”£
£Ø3£©ĪĀ¶ČTŹ±·“Ó¦“ļĘ½ŗāŗ󣬽«·“ӦȯĘ÷µÄČŻ»ż¼õÉŁŅ»°ė£¬Ę½ŗāĻņ_______£ØĢī”°Õż·“Ó¦”±»ņ”°Äę·“Ó¦”±£©·½ĻņŅĘ¶Æ£¬ÅŠ¶ĻĄķÓÉŹĒ__________________”£
£Ø4£©ŅŃÖŖ£ŗ
¼×“¼ĶŃĖ®·“Ó¦2CH3OH(g)£½CH3OCH3(g)£«H2O(g) ”÷H1£½£23.9kJ”¤mol£1
¼×“¼ÖĘĻ©Ģž·“Ó¦2CH3OH(g)£½C2H4 (g)£«H2O(g) ”÷H2£½£29.1kJ”¤mol£1
ŅŅ“¼Ņģ¹¹»Æ·“Ó¦2CH3OH(g)£½CH3OCH3(g)) ”÷H3£½£«50.7kJ”¤mol£1
ŌņŅŅĻ©ĘųĻąÖ±½ÓĖ®ŗĻ·“Ó¦C2H4 (g)£«H2O(g)£½C2H5OH(g)µÄ”÷H£½____________ kJ”¤mol£1”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com