
某元素的一个原子形成的离子可表示为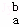 Xn﹣,下列说法正确的是( )
Xn﹣,下列说法正确的是( )
A. 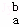 Xn﹣含有的中子数为a+b
Xn﹣含有的中子数为a+b
B. 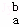 Xn﹣含有的电子数为a﹣n
Xn﹣含有的电子数为a﹣n
C. X原子的质量数为a+b+n
D. 一个X原子的质量约为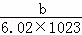 g
g
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1:4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是 ,该反应的化学方程式是 .
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 .
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是 (填所在周期和族);Y的化学式是NO.
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是 mol.
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
关于铅蓄电池的说法正确的是()
A. 在放电时,正极发生的反应是Pb(s)+SO42﹣(aq)﹣2e﹣=PbSO4(s)
B. 在放电时,该电池的负极材料是铅板
C. 在充电时,电池中硫酸的浓度不断变小
D. 在充电时,阳极发生的反应是P bSO4(s)+2e﹣=Pb(s)+SO42﹣(aq)
bSO4(s)+2e﹣=Pb(s)+SO42﹣(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在材料领域中应用广泛.下列叙述中不正确的是( )
A. 硅单质可用来制造太阳能电池
B. 装碱性溶液的玻璃试剂瓶不能用玻璃塞
C. 二氧化硅是制造光导纤维的材料
D. 二氧化硅属于酸性氧化物,不能与任何酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钠与CO2作用,反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2.当0.2mol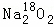 与足量CO2完全反应后,如表所示对生成物Na2CO3和O2的描述中正确的是( )
与足量CO2完全反应后,如表所示对生成物Na2CO3和O2的描述中正确的是( )
选项 Na2CO3的质量 关于O2的描述
A 21.2g O2的摩尔质量是36g•mol﹣1
B 21.6g 生成标准状况下O2的体积为2.24L
C 21.6g O2的摩尔质量是34g•mol﹣1
D 22.4g 生成标准状况下O2的体积
为2.24mL
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,正确的是( )
A. 氧化亚铁和稀硝酸反应FeO+2H+═Fe2++H2O
B. 硫酸铝溶液与足量烧碱:Al3++3OH﹣=Al(OH)3↓
C. 氯化亚铁溶液中滴入氯水Cl2+2Fe2+═2Cl﹣+2Fe3+
D. 金属铝投入NaOH溶液中2Al+2OH﹣+2H2O═2AlO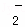 +2H2↑
+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于燃烧热的说法中正确的是()
A. 1 mol物质燃烧所放出的热量
B. 常温下,可燃物燃烧放出的热量
C. 在25℃、1.01×105Pa时,1mol纯物质燃烧生成稳定的氧化物时所放出的热量
D. 燃烧热随化学方程式前的化学计量数的改变而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
在同温同压下,下列各组热化学方程式中,△H1>△H2的是()
A. 2H2(g)+O2(g)═2H2O(l)△H1;2H2(g)+O2(g)═2H2O(g)△H2
B. S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2
C. C(s)+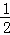 O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
D. H2(g)+Cl2(g)═2HCl(g)△H1;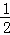 H2(g)+
H2(g)+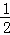 Cl2(g)═HCl(g)△H2
Cl2(g)═HCl(g)△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
三草酸合铁酸钾(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.
完成下列填空:
某实验小组为测定该晶体中铁的含量和结晶水的含量,做了如下实验:
(一)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL 于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4﹣同时被还原为Mn2+.向反应后的溶液中加入锌粉,加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4﹣被还原成Mn2+.
重复步骤二和步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL.
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、溶解、冷却、转移、洗涤并转移、 、摇匀.
(2)加入锌粉的目的是 .
(3)写出步骤三中发生反应的离子方程式 .
(4)实验测得该晶体中铁的质量分数为 .在步骤二中,若滴加的KMnO4溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”或“不变”)
(二)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.
(5)请纠正上述实验过程中的两处错误: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com